以下文章來源于:瞪羚社
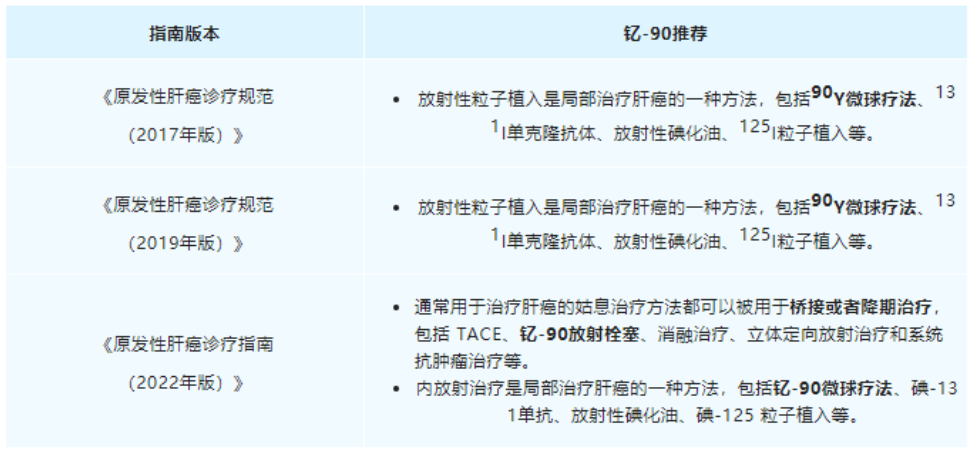
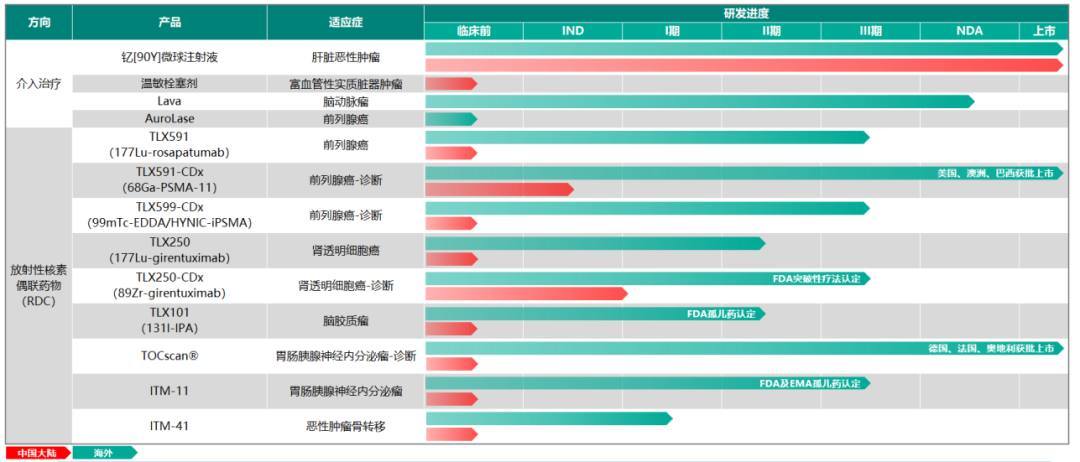
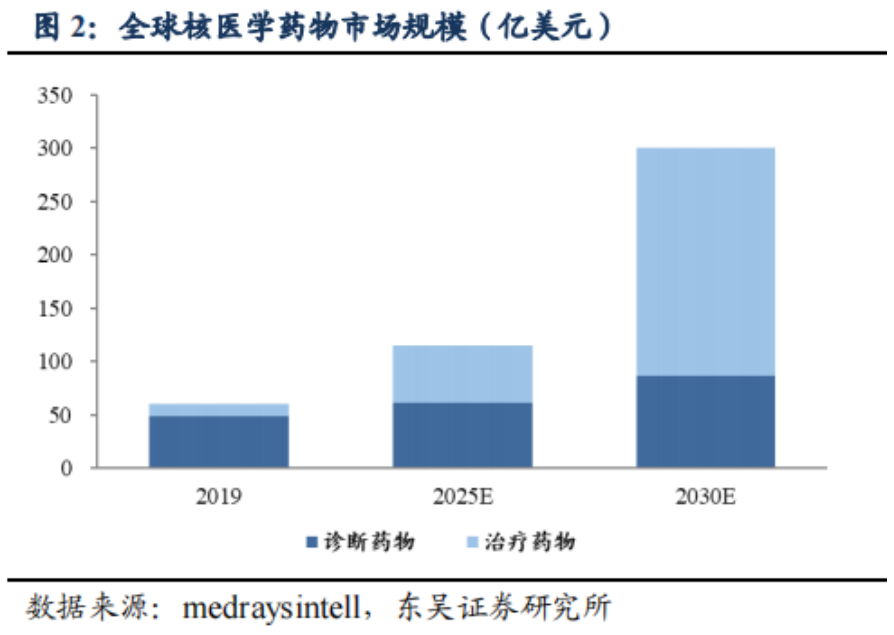
從2021年9月海南“先行先試”實施中國首例特許準入釔[90Y]治療肝癌項目,到2022年1月釔[90Y]在中國大陸獲批上市,再到2022年5月產(chǎn)品正式投入臨床使用���,釔[90Y]微球注射液治療技術(shù)持續(xù)在國內(nèi)普及��,至今已過去一年的時間���。就在近日,董家鴻院士團隊在北京清華長庚醫(yī)院成功實施了北京市首例釔[90Y]微球注射液手術(shù)��,更是標志著釔[90Y]微球注射液治療已在國內(nèi)環(huán)保政策最為嚴苛地區(qū)(北京)實現(xiàn)正式落地�。肝癌治療新選擇,北京長庚醫(yī)院首例釔[90Y]手術(shù)開臺2022年9月28日��,中國工程院院士����、北京清華長庚醫(yī)院院長董家鴻及其團隊在北京清華長庚醫(yī)院成功實施了北京市首例釔[90Y]微球注射液手術(shù)。28日至30日連續(xù)3天����,共有6例肝腫瘤患者在北京清華長庚醫(yī)院順利接受釔[90Y]手術(shù)。同月�����,北京清華長庚醫(yī)院成功獲批釔[90Y]微球注射液治療輻射安全許可和放射診療許可資質(zhì),成為北京市首家獲批資質(zhì)的單位��。正如董家鴻院士指出���,我國是肝癌大國����,每年肝癌新發(fā)病例達40萬例�����,占全球肝癌新發(fā)病例近一半�����,多數(shù)患者發(fā)現(xiàn)時已是中晚期�����,僅20%至30%的肝癌患者可以手術(shù)切除��,且5年內(nèi)復(fù)發(fā)率仍高達60%~70%����。同時,我國結(jié)直腸癌每年新發(fā)病人數(shù)約55萬��,其中半數(shù)存在肝轉(zhuǎn)移��。釔[90Y]微球注射液治療技術(shù)的使用和推廣�,將為肝腫瘤患者增加了一種治療更精準、療效良好的診療方案選擇�����。釔[90Y]治療技術(shù)的使用和推廣����,讓肝腫瘤的治療進入多元化時代。董院士還表示:“北京清華長庚醫(yī)院今后將常態(tài)化開展釔[90Y]微球治療���,以強大的多學(xué)科聯(lián)合診療團隊為支撐�����,為北京地區(qū)乃至全國的肝臟腫瘤患者帶來更加精準的診療方案和更為顯著的臨床獲益�?�!?/span>釔[90Y]國內(nèi)應(yīng)用持續(xù)推廣���,肝癌治療臨床價值獲認可在過去的一年里�����,釔[90Y]的治療不僅實現(xiàn)了一次又一次的良好臨床療效���,取得了多個關(guān)鍵性突破��,而且在肝癌治療領(lǐng)域也展現(xiàn)出了巨大的潛力�。2021年9月��,遠大醫(yī)藥全球創(chuàng)新產(chǎn)品釔[90Y]微球注射液順利由董家鴻院士及其團隊在海南博鰲超級醫(yī)院完成了中國首例特許準入的肝癌患者臨床治療工作���。根據(jù)術(shù)后2個多月的檢查結(jié)果顯示�����,患者肝部腫瘤明顯縮小,有活性的腫瘤直徑從原來的10.81厘米縮小到1.8厘米���,縮小為原來腫瘤的十分之一大小��,作為原發(fā)性肝癌特異性標志物的甲胎蛋白(AFP)也已從術(shù)前180,446ng/ml降為1,469ng/ml�����,患者獲得進一步手術(shù)機會及徹底根治的可能性�。2022年1月復(fù)查時影像學(xué)評估該患者腫瘤活性病灶完全消退。2022年3月���,該名接受了中國首例釔[90Y]微球注射液內(nèi)放射治療肝癌的患者在北京清華長庚醫(yī)院成功接受了董家鴻院士親自操刀進行解剖性肝切除手術(shù)�。術(shù)后恢復(fù)良好出院�����,并已獲得臨床治愈��。這標志著中國肝臟惡性腫瘤治療領(lǐng)域迎來全新國際化精準介入內(nèi)放射治療方案��,具有開創(chuàng)性的里程碑意義���。2022年6月�,北京清華長庚醫(yī)院董家鴻院士團隊順利為中國第二例特許準入釔[90Y]微球注射液治療后的患者進行治愈性肝切除手術(shù)����。術(shù)后患者恢復(fù)良好,病理證實腫瘤病灶完全壞死���,實現(xiàn)臨床治愈�����。同月����,浙江省腫瘤醫(yī)院副院長邵國良教授帶領(lǐng)治療團隊,成功為2例結(jié)腸癌肝轉(zhuǎn)移患者實施釔[90Y]微球精準介入治療手術(shù)�����,在浙江省屬首次�����。根據(jù)患者術(shù)后1月復(fù)查結(jié)果顯示�����,釔[90Y]治療腸癌肝轉(zhuǎn)移安全有效���,效果顯著。此外����,今年4月至今��,還有數(shù)例釔[90Y]微球精準治療手術(shù)在南京等地成功實施���。作為美國食品藥品監(jiān)督管理局(FDA)正式批準的第一款正式用于結(jié)直腸癌肝轉(zhuǎn)移的內(nèi)放射性微球產(chǎn)品,釔[90Y]微球注射液已在全球超過60個國家和地區(qū)累計治療超過15萬人次��,無明顯不良反應(yīng)�����,其安全性和有效性已經(jīng)得到充分驗證�����,被美國����、歐洲、英國及中國的主流診療指南推薦��。其中����,國家衛(wèi)健委于今年1月8日發(fā)布的《原發(fā)性肝癌診療指南(2022年版)》���,在2019年版基礎(chǔ)上,對釔[90Y]微球療法新增了橋接與降期治療的用法推薦����,充分表明了國內(nèi)專家對釔[90Y]微球臨床價值的進一步認可。正如早前天津醫(yī)科大學(xué)腫瘤醫(yī)院黨委書記��、肝癌防治研究中心主任陸偉教授所介紹�����,“不像傳統(tǒng)的開腹手術(shù)���,釔[90Y]微球注射液更像是一發(fā)精準制導(dǎo)的微型核彈�����,前期通過精準定位��,將帶有合理放射線的釔[90Y]微球注射液通過介入手段直達腫瘤內(nèi)部�����,通過釋放β射線集中快速殺滅腫瘤細胞�����,而對周圍健康組織不造成影響���,相比較傳統(tǒng)治療模式,釔[90Y]微球注射液精準治療技術(shù)具備一定的優(yōu)勢�����,能為患者帶來更多獲益���?!?/span>正是基于釔[90Y]在肝癌治療領(lǐng)域展現(xiàn)出的顯著臨床療效和巨大潛力�����,自釔[90Y]于2022年1月在中國大陸獲批上市后��,國內(nèi)近20家知名醫(yī)院在極快的時間里完成了產(chǎn)品的醫(yī)院準入和團隊的培訓(xùn)����,多數(shù)醫(yī)院均由院長或者分管副院長牽頭成立釔[90Y]精準介入診療多學(xué)科會診(MDT)團隊并啟動了培訓(xùn)���,體現(xiàn)了國內(nèi)專家對釔[90Y]的認可,以及迫切的臨床需求�����。值得一提的是��,由于核藥具備一定的放射性��,受國家嚴格監(jiān)管���,目前治療性核藥在國內(nèi)推廣難度較高��,行業(yè)有著較高的準入壁壘�����,僅有少數(shù)企業(yè)具備自主生產(chǎn)核藥的能力��。遠大醫(yī)藥憑借其在核藥領(lǐng)域展現(xiàn)出的多方面綜合優(yōu)勢�,持續(xù)推進釔[90Y]在國內(nèi)各省市醫(yī)院的廣泛應(yīng)用�����,成為了國內(nèi)第一家將治療性核藥做到快速市場準入與推廣并獲得廣大醫(yī)患認可的公司。據(jù)統(tǒng)計���,目前釔[90Y]微球注射液手術(shù)治療已在國內(nèi)15個省市的20余家醫(yī)院開展��,今年5月釔[90Y]正式上市后的3個月隨訪顯示��,患者響應(yīng)整體較為理想,大部分患者均獲得很好的臨床療效��,延長生存。同時,遠大醫(yī)藥也已對國內(nèi)70家醫(yī)院超過300名醫(yī)生進行了釔[90Y]手術(shù)理論或技能培訓(xùn)���。核藥布局將迎收獲期�����,百億核藥賽道前景可期實際上��,釔[90Y]微球注射液只是遠大醫(yī)藥在核藥抗腫瘤診療領(lǐng)域的其中一款核心產(chǎn)品�。通過圍繞腫瘤診療一體化的治療理念,目前遠大醫(yī)藥已經(jīng)儲備了包括易甘泰?釔[90Y]微球注射液在內(nèi)的13款創(chuàng)新產(chǎn)品����,涵蓋6種核素,覆蓋了肝癌���、前列腺癌��、腦癌等在內(nèi)的8個癌種。同時公司在核藥領(lǐng)域也實現(xiàn)了多個環(huán)節(jié)的全方位布局,并建立了完整的產(chǎn)業(yè)鏈�。具體來看�,遠大醫(yī)藥的核藥抗腫瘤診療板塊產(chǎn)品主要分為介入治療和RDC(放射性核素偶聯(lián)藥物)兩大類別����。其中����,介入治療方面,除了釔[90Y]微球注射液(預(yù)計2022年底提交針對原發(fā)肝癌適應(yīng)癥的IND申請)以外��,公司還布局了多款全球創(chuàng)新產(chǎn)品���,包括溫度敏感性栓塞劑、液體栓塞劑LavaTM(預(yù)計2023年上半年在美國獲批上市)���、實體瘤消融治療技術(shù)AuroLase?��;RDC藥物方面��,目前遠大醫(yī)藥擁有9款全球創(chuàng)新產(chǎn)品���,包括前列腺癌診療產(chǎn)品TLX591/TLX591-CDx/TLX599-CDx���,其中TLX591-CDx已在澳大利亞��、美國上市��,并在巴西獲得特別授權(quán)于正式獲批前銷售�,該產(chǎn)品同時已在17個國家遞交了上市申請。TLX591-CDx在美國上市后��,其銷售收入取得了超預(yù)期的增長��,產(chǎn)品第二季度全球銷售收入實現(xiàn)約2,250萬澳元,環(huán)比增長超過10倍�。此外����,公司亦布局透明細胞腎細胞癌(ccRCC)診療產(chǎn)品 TLX250/TLX250-CDx�,其中TLX250-CDx已獲FDA授予突破性療法���,其國內(nèi)IND已獲國家藥監(jiān)局批準,其海外III期臨床研究在今年7月已完成全部300例受試者招募�����,預(yù)計在今年下半年完成研究并匯報結(jié)果�����;膠質(zhì)母細胞瘤治療產(chǎn)品 TLX101(已獲FDA孤兒藥認定)、胃腸胰腺神經(jīng)內(nèi)分泌瘤(GEP-NETs)診療產(chǎn)品 ITM-11/TOCscan?,其中ITM-11獲得FDA和歐洲藥品管理局(EMA)的孤兒藥資格��,海外正在開展III期臨床研究;TOCscan?已于2018年在德國��、奧地利�����、法國獲批上市;以及惡性腫瘤骨轉(zhuǎn)移治療產(chǎn)品ITM-41。不難看出�����,遠大醫(yī)藥在核藥抗腫瘤診療領(lǐng)域布局了豐富多元的產(chǎn)品線�,在研產(chǎn)品均為全球創(chuàng)新型����,且多數(shù)處于臨床后期階段�����,意味著未來幾年將迎來產(chǎn)品上市收獲期���,市場潛力巨大����。從行業(yè)前景看��,核藥賽道一直得到資本市場的持續(xù)關(guān)注����,今年以來更是頻頻出現(xiàn)投融資項目��。例如��,開發(fā)放射性藥物的新銳公司輻聯(lián)醫(yī)藥半年內(nèi)連獲兩輪融資�����,分別是由成為資本和革錠創(chuàng)投聯(lián)合領(lǐng)投的1000萬美元種子輪融資��,以及由紅杉中國領(lǐng)投的近2.5億人民幣A輪融資�����;專注于靶向核藥研發(fā)的晶核生物一年內(nèi)順利完成兩輪融資���,分別是凱泰資本和沂景資本領(lǐng)投的數(shù)千萬人民幣的種子輪融資����,以及由高榕資本領(lǐng)投的近億元人民幣天使輪融資�����。另外����,從市場空間看�����,根據(jù)MEDraysintell數(shù)據(jù)��,2019年全球核藥市場規(guī)模約60億美元��,其中診斷藥物占據(jù)主要市場���,但隨著越來越多的治療性藥物上市�����,將推動2030年全球核藥市場達到300億美元左右����。根據(jù)弗若斯特沙利文分析�,2017年中國核藥市場規(guī)模約44億元�,預(yù)計2022年將達到106億元,隨著國內(nèi)核藥研究的持續(xù)完善,預(yù)計中國核藥市場將持續(xù)擴容�����。此外����,遠大醫(yī)藥在核藥抗腫瘤診療板塊還實現(xiàn)了研發(fā)�、生產(chǎn)��、銷售��、監(jiān)管資質(zhì)等多個環(huán)節(jié)的全方位布局,建立了完整的產(chǎn)業(yè)鏈����。遠大醫(yī)藥表示�����,未來1-2年內(nèi)�����,公司將持續(xù)加強核藥抗腫瘤診療板塊的研發(fā)和投入�����,豐富和完善產(chǎn)品管線及產(chǎn)業(yè)布局,在中國建立至少1個甲級資質(zhì)生產(chǎn)平臺�,實現(xiàn)25個以上核藥抗腫瘤診療產(chǎn)品的管線布局�����,形成以易甘泰?釔[90Y]微球注射液為核心的核藥抗腫瘤診療產(chǎn)品集群���。政策助力����、全球化布局加持,遠大醫(yī)藥有望成為核藥市場的“獨角獸”從長遠來看�,遠大醫(yī)藥在國家利好政策的助力和在核藥抗腫瘤診療板塊的全球化布局加持下�,逐漸展現(xiàn)出良好的成長前景���。近年來����,我國放射性藥物市場發(fā)展迅速�����,配套的政策指引也為中國核醫(yī)學(xué)的發(fā)展按下加速鍵�����。2021年國家發(fā)布的首個針對核技術(shù)在醫(yī)療衛(wèi)生應(yīng)用領(lǐng)域的綱領(lǐng)性文件《醫(yī)用同位素中長期發(fā)展規(guī)劃(2021-2035年)》���,對于提升中國醫(yī)用同位素相關(guān)產(chǎn)業(yè)能力水準�����,推動和規(guī)范中國放射性體內(nèi)診斷藥物的研發(fā)極具意義����。今年以來��,國家藥監(jiān)局還接連出臺了一系列利好核藥中長期發(fā)展的規(guī)范政策����。今年1月國家藥監(jiān)局發(fā)布的《關(guān)于進一步加強放射性藥品管理有關(guān)事宜的通告(2022年第5號)》����,對進一步加強放射性藥品生產(chǎn)管理,保證放射性藥品質(zhì)量安全有效具有重要意義。特別是9月30日,國家藥監(jiān)局發(fā)布《關(guān)于改革完善放射性藥品審評審批管理的意見(征求意見稿)》�����,以向全社會公開征求意見����,其中明確說明了放射性藥品在惡性腫瘤���、心腦血管疾病等診斷與治療方面具有特殊重要作用,以及近年來黨中央國務(wù)院高度重視放射性藥品研發(fā)與應(yīng)用��,鼓勵放射性藥品研發(fā)申報。在《(征求意見稿)》中�,國家藥監(jiān)局提到“鼓勵藥品研發(fā)�,滿足臨床急需”����,也就是鼓勵以臨床價值為導(dǎo)向的放射性藥品創(chuàng)新��,對放射性藥品注冊申請給予優(yōu)先審評審批,以及“優(yōu)化審評機制�,體現(xiàn)放射性藥品特殊性”����,從而完善放射性藥品技術(shù)審評體系�。不難看出,以上這些規(guī)范政策就如同2015年實施的藥品醫(yī)療器械審評審批制度改革����,使得我國創(chuàng)新藥產(chǎn)業(yè)進入快速發(fā)展期一樣,現(xiàn)如今在頂層制度的設(shè)計下�,核藥產(chǎn)業(yè)也將迎來最好的發(fā)展時機�。正因如此,遠大醫(yī)藥緊跟政策方向���,前瞻性的布局了醫(yī)用同位素生產(chǎn)�����,推進創(chuàng)新核藥抗腫瘤診療平臺建設(shè)��,并完善核藥的監(jiān)管���、注冊、研發(fā)�、原料、運輸�����、進院等產(chǎn)業(yè)鏈環(huán)節(jié)�,為公司放射性核素藥物的落地奠定堅實的基礎(chǔ)。2022年年初,十四五規(guī)劃中將微球類注射劑�、藥械組合等新機制創(chuàng)新藥作為未來重點發(fā)展的對象。同年6月�,首個亞洲釔[90Y]樹脂微球選擇性內(nèi)放射治療的臨床專家共識發(fā)布�����,對公司釔[90Y]微球注射液的規(guī)范臨床診療具有重要指導(dǎo)意義。同時���,滬惠保等區(qū)域性惠民險對該產(chǎn)品治療使用的覆蓋也有望大幅提高患者的可及性����。結(jié)語:總結(jié)來看,遠大醫(yī)藥所處的核藥領(lǐng)域具有典型的臨床價值高����、壁壘高、增速高的“三高”特征���,屬于資本市場密切關(guān)注的賽道。遠大醫(yī)藥通過長期的布局,逐漸鞏固了公司在核藥抗腫瘤診療的競爭優(yōu)勢�����,已成為中國核藥抗腫瘤診療的龍頭企業(yè)���。在這一不進則退的市場環(huán)境中�,隨著未來幾年公司產(chǎn)品上市收獲期的到來,遠大醫(yī)藥也有望成為核藥市場的“獨角獸”�,笑傲江湖。