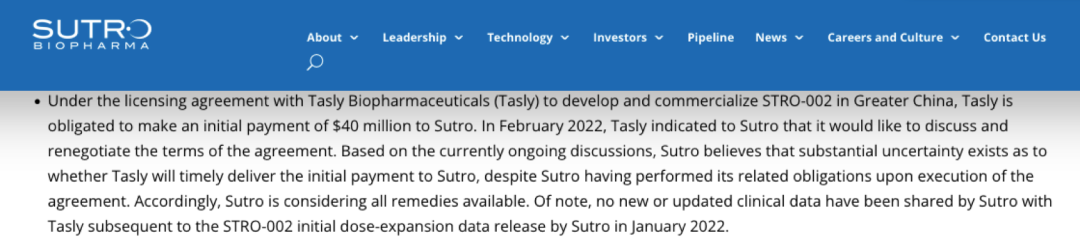
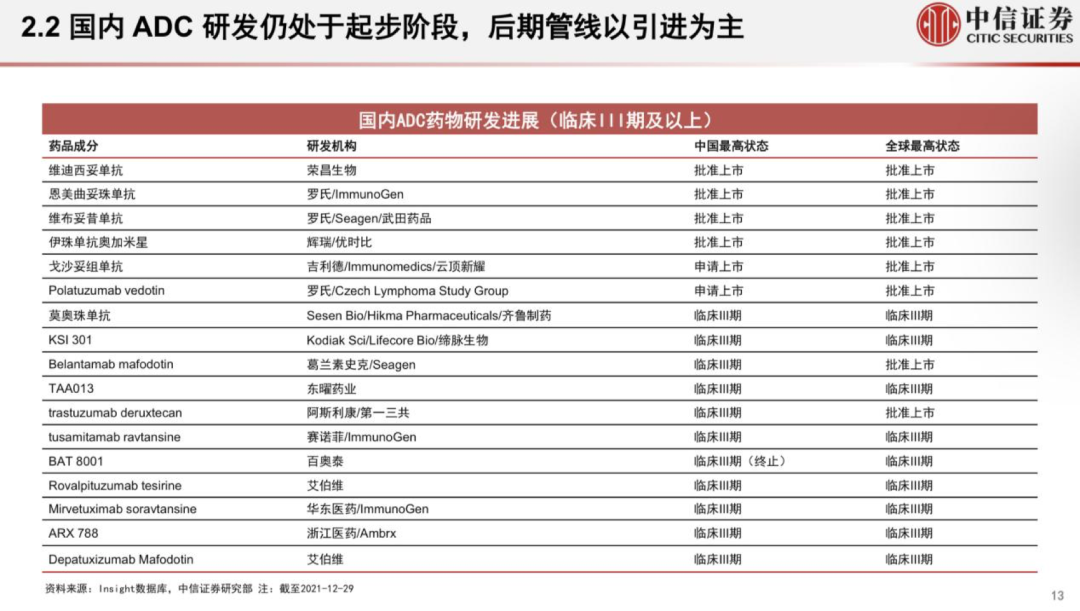
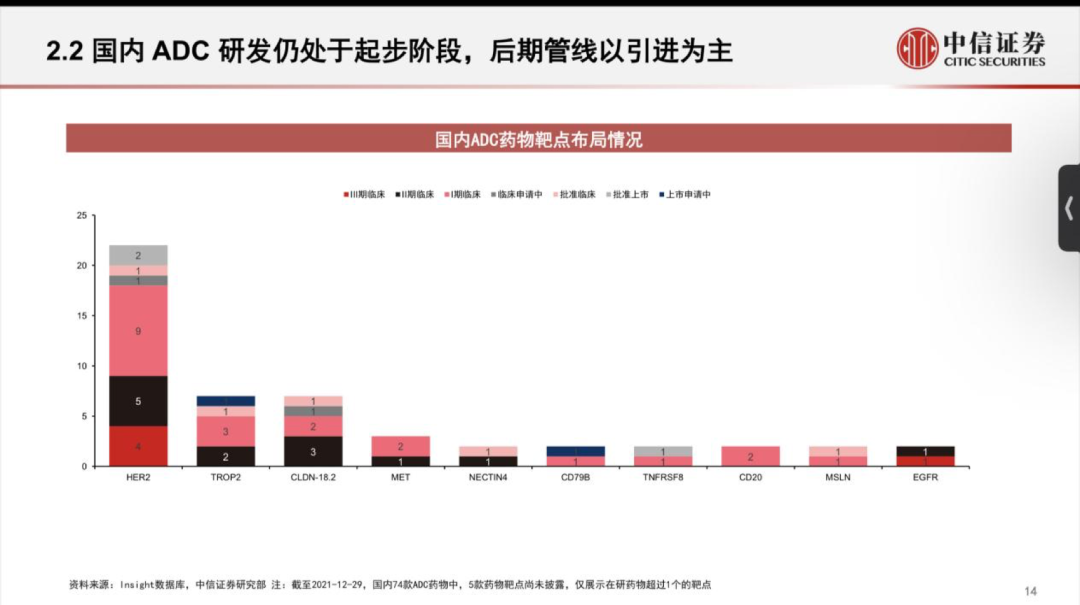
國內(nèi)ADC新貴樂普生物成功登陸港交所��;華東醫(yī)藥9.3億美元大手筆引進4款A(yù)DC新藥;天士力與Sutro Biopharma關(guān)于ADC藥物合作或?qū)⒅匦掠懻?����。近來����,熱度居高不下的國?nèi)ADC藥物市場近來頗為活躍����。如今國內(nèi)的ADC賽道,傳統(tǒng)大藥企與biotech新貴站在同場競技的舞臺����。ADC藥物領(lǐng)頭羊榮昌生物已有7條ADC產(chǎn)品管線,多禧生物則布局了多達17條產(chǎn)品管線�。國內(nèi)大藥企中,恒瑞�����、華東也已經(jīng)紛紛上陣�����,通過自研或引進,布局自身的ADC產(chǎn)品管線��。 放眼全球�����,國際巨頭也正在大力布局這一賽道��,吉利德210億美元收購Immunomedics��,第一三共與阿斯利康達成120億美元的合作���,衛(wèi)材與BMS達成31億美元共同開發(fā)協(xié)議���,強生和禮來也分別投入超10億美元入局ADC賽道。距離2000年后才上市的首款A(yù)DC產(chǎn)品不過20年的時間��,如今這一賽道已經(jīng)身處“舊靶點同質(zhì)化�,新靶點風險大”的時代。01 僅3款進臨床�,F(xiàn)Rα靶點嶄露頭角 在日前發(fā)布的Sutro Biopharma公司年報中顯示,其與天士力的ADC藥物合作或?qū)⒈惶焓苛χ匦驴紤]�����。距離兩家公司“官宣”合作僅3個月有余,為何突然現(xiàn)在傳出可能終止的情況��? 去年12月24日��,天士力宣布獲得Sutro Biopharma公司靶向葉酸受體α(FRα)的抗體偶聯(lián)藥物 STRO-002 在中國大陸及港澳臺的獨家開發(fā)和商業(yè)化權(quán)益�����,交易金額包括 4000 萬美元首付款和潛在最高 3.45 億美元的開發(fā)及商業(yè)化里程碑付款�,以及約定比例的銷售提成��。已擁有16條生物藥管線的天士力���,引進STRO-002進軍ADC市場�,也被業(yè)內(nèi)看作拓寬腫瘤治療藥物產(chǎn)品管線���、提升產(chǎn)品組合的重要舉措��。FRα在腫瘤中的高度表達讓其成為一個新的備受關(guān)注的靶點�。FRα具有腫瘤細胞特異性�����,在卵巢癌、子宮內(nèi)膜癌��、乳腺癌和非小細胞肺癌等腫瘤組織中高表達��,在正常組織中不表達或者表達量非常低����。有研究顯示,F(xiàn)Rα在76%-89%的上皮卵巢癌中高度表達���,在35%-68%的三陰性乳腺癌中高度表達�。因此靶向FRα有望特異性治療包括卵巢癌����、非小細胞肺癌(NSCLC)、乳腺癌和子宮內(nèi)膜癌等多種實體瘤�����。天士力所布局的FRα靶點����,當前在全球范圍內(nèi)尚無藥物獲批上市。從處于臨床階段的項目數(shù)量來看,布局于此的產(chǎn)品相較HER2等熱門靶點而言較少����。處于臨床階段的藥物僅有三款,包括ImmunoGen公司的IMGN853��、衛(wèi)材公司的MORAb-202與Sutro Biopharma公司的STRO-002����。因此不難解釋天士力斥資近4億美元選擇這款藥物的原因,可以通過避免同質(zhì)化競爭���,進而實現(xiàn)產(chǎn)品的差異化發(fā)展。從臨床試驗進度來看���,ImmunoGen公司處于臨床III期的IMGN853有望成為該靶點首個獲批的ADC產(chǎn)品��。IMGN853是全球首個針對FRα陽性卵巢癌的ADC候選藥����,擬開發(fā)用于葉酸受體α高表達���、且對鉑耐藥的卵巢癌患者�����,屬于全球首創(chuàng)產(chǎn)品���。IMGN853是目前靶向FRα藥物中進展最快的��,ImmunoGen公司此前預(yù)計2022年第一季度在美國遞交IMGN853 的生物制品許可申請(BLA)�����。 早在2020年10月�����,華東醫(yī)藥全資子公司杭州中美華東制藥有限公司便與ImmunoGen達成協(xié)議�����,獲得IMGN853在大中華區(qū)的獨家臨床開發(fā)及商業(yè)化權(quán)益����。交易總金額超過3億美元��。去年3月31日�,華東制藥申報的IMGN853已獲得國內(nèi)臨床默示許可,適應(yīng)癥為葉酸受體α高表達的鉑類耐藥的晚期高級別上皮性卵巢癌、原發(fā)性腹膜癌或輸卵管癌患者���。 而另一款來自衛(wèi)材和BMS合作開發(fā)的MORAb-202�,有望摘下“Best-in-class”桂冠����。MORAb-202是衛(wèi)材開發(fā)的首個ADC產(chǎn)品,由衛(wèi)材研發(fā)的FRα抗體farletuzumab和抗癌藥eribulin組成�����,具有良好的藥理學(xué)特征�,并在晚期實體瘤患者中表現(xiàn)出單藥活性。在去年6月�,衛(wèi)材和BMS就MORAb-202的共同開發(fā)和商業(yè)化達成了獨家全球戰(zhàn)略合作協(xié)議。根據(jù)協(xié)議�,衛(wèi)材和BMS將在亞太國家(包括日本�����、中國)���、美國���、加拿大���、歐洲(包括歐盟和英國)和俄羅斯共同開發(fā)和商業(yè)化MORAb-202。BMS將全權(quán)負責在合作區(qū)域以外開發(fā)和商業(yè)化該藥物����。衛(wèi)材則繼續(xù)負責全球的生產(chǎn)和供應(yīng),該筆交易的總額高達31億美元�。 MORAb-202目前正在日本開展I期臨床試驗、并在美國進行I/II期臨床試驗�����,用以評估MORAb-202靶向治療FRα陽性實體瘤(包括子宮內(nèi)膜癌���、卵巢癌�、肺癌和乳腺癌)的效果�。 STRO-002同樣是“Best-in-class”的有力競爭者。目前正在歐美開展針對復(fù)發(fā)卵巢癌和子宮內(nèi)膜癌的I期臨床研究���,其中復(fù)發(fā)卵巢癌劑量爬坡研究已于2020年8月完成���。在2021年的ASCO會議中,Sutro公布了相關(guān)臨床數(shù)據(jù),數(shù)據(jù)顯示���,STRO-002針對多線治療后復(fù)發(fā)的鉑耐藥/復(fù)發(fā)卵巢癌具有積極的初步療效�,且安全耐受性良好�。基于此數(shù)據(jù)���,Sutro擬與FDA溝通以II期單臂研究作為注冊臨床申請加速審批上市���。此外,Sutro還計劃在美國啟動一項STRO-002與貝伐珠單抗聯(lián)用治療復(fù)發(fā)卵巢癌的臨床研究�。同時,STRO-002也有潛力擴展到其他腫瘤適應(yīng)癥如葉酸受體α表達陽性的三陰性乳腺癌和NSCLC等�����,Sutro表示���,針對NSCLC的臨床前研究也正在進行中。值得注意的是����,與另外兩款靶向FRα的ADC產(chǎn)品的最大差異是,STRO-002是目前唯一一款處于臨床試驗階段、不區(qū)分患者FRα表達水平的產(chǎn)品�����,因此�����,業(yè)內(nèi)認為有望成為“best-in-class”產(chǎn)品�����。讓人感到意外的是�,Sutro Biopharma在其年報中披露,天士力已于今年2月表明將重新討論與Sutro關(guān)于FRα ADC新藥STRO-002的合作��,Sutro稱天士力有權(quán)在適當?shù)臅r侯或者因為適當?shù)脑蚪K止合作��。從消息面上來看���,不論是Sutro 還是天士力���,都沒有向外界透露可能重新討論合作的原因。但分析人士認為�����,這可能與Sutro最新公布的STRO-002的I期臨床數(shù)據(jù)中透露出的安全性問題有關(guān)。最新數(shù)據(jù)顯示�����,雖然安全性方面并沒有出現(xiàn)新的副作用信號����,但有1例中性粒細胞減少癥引起的死亡。為此�,Sutro調(diào)整了試驗方案,出現(xiàn)4級中性粒細胞減少時采取必要的劑量減少����。的確,ADC藥物的劑量策略一直是監(jiān)管機構(gòu)關(guān)注的重點之一����。今年2月,F(xiàn)DA曾發(fā)布了一份ADC監(jiān)管指南草案�����,其中提到����,由于ADC分子本身由抗體和細胞毒性藥物組成,最優(yōu)的劑量策略需要考慮到抗體藥物和載荷藥物在藥代動力學(xué)和藥效學(xué)上的區(qū)別�。雖然ADC技術(shù)不斷螺旋上升,逐漸演化到第三代����,已經(jīng)展現(xiàn)出了良好的穩(wěn)定性和藥代動力學(xué),在提高療效的同時��,毒性反應(yīng)明顯降低���。但是��,ADC產(chǎn)品仍面臨著毒性問題�,對于藥物而言�����,通過開發(fā)新的靶點或進一步充分利用已驗證靶點給患者帶來有效安全的ADC藥物治療方案成為首當其沖的挑戰(zhàn)之一���。 或許��,對于ADC藥物安全性的考量���,是影響天士力與Sutro Biopharma未來合作的不確定因素���。02 同質(zhì)化、商業(yè)化競爭�,ADC已陷入激戰(zhàn)ADC藥物猶如帶刺的玫瑰,雖然已上市的不少產(chǎn)品因擁有“誘人”的療效不斷刷新已有的標準療法�,但作為一類全新的分子類型,不僅是產(chǎn)品的毒性和副作用問題引人關(guān)注��,但是在同質(zhì)化靶點與商業(yè)化競爭的壓力���,讓一眾ADC研發(fā)企業(yè)扎心�。如國內(nèi)首款自主研發(fā)上市的ADC產(chǎn)品維迪西妥單抗(RC48)���,盡管有望獲得西雅圖基因最高可達 24 億美元的里程碑付款���,但是其要面對的商業(yè)化競爭壓力并不輕松。如僅針對胃癌適應(yīng)癥上�,截至 2021 年 7 月 31 日,已有多款用于胃癌治療的創(chuàng)新生物藥在美國獲批���, 而中國僅維迪西妥單抗���、曲妥珠單抗及納武利尤單抗三款生物藥實現(xiàn)商業(yè)化�����,還有7 款靶向 HER2 的創(chuàng)新生物藥處于臨床試驗階段。有數(shù)據(jù)預(yù)測���,維迪西妥單抗2022年預(yù)計銷售額為4億元���。根據(jù)當前已經(jīng)披露的ADC產(chǎn)品的銷售額來看,他們距離成為超級重磅炸彈仍有較大的距離��。當前僅有兩款A(yù)DC產(chǎn)品銷售額超過了10億美元�,多款產(chǎn)品的銷售業(yè)績?nèi)圆蛔?億美元。被稱為是全球商業(yè)化最成功的ADC藥物��,羅氏的Kadcyla���,其2021年銷售額增長16%����,達到19.82億瑞士法郎���。但是它能否繼續(xù)保持這樣的高增長仍充滿變數(shù)�����,在2022年該產(chǎn)品將面臨ADC產(chǎn)品新秀Enhertu在二線乳腺癌適應(yīng)癥上的競爭��。Kadcyla于2013年獲FDA批準上市���,為全球首款用于治療實體瘤的ADC產(chǎn)品�����。這是羅氏繼赫賽汀(曲妥珠單抗)和帕捷特(帕妥珠單抗)之后推出的第三款HER2產(chǎn)品����。在療效上�,Kadcyla對比化療延長患者無進展生存期9.6個月,NCCN指南將其列為HER2陽性乳腺癌二線治療首選方案��。 來自西雅圖基因的Adcetris (維布妥昔單抗)��,是靶向CD30的ADC藥物���。該產(chǎn)品自2011年上市后�����,圍繞治療經(jīng)典霍奇金淋巴瘤(cHL)和系統(tǒng)性間變性大細胞淋巴瘤(sALCL)已經(jīng)獲批了6個適應(yīng)癥 ��。2020年�����,Adcetris銷售額達到12.14億美元��,2021年銷售額達13.06億美元Clarivate預(yù)測��,Adcetris的全球銷售額在2024年將突破20億美元���。與前兩個先行者的銷售情況不同,Enhertu勢頭相當兇猛�。該產(chǎn)品僅上市一年,在2020年的銷售額就達9600萬美元�,2021年該產(chǎn)品就攬獲了4.26億美元(日本以外市場),同比增長123%�,成為阿斯利康的新增長極。Enhertu彌補HER2陽性患者三線標準治療空白�����,對HER2+乳腺癌伴腦轉(zhuǎn)移患者同樣有效。該產(chǎn)品是公認療效最強的HER2 ADC��,但是其引發(fā)肺間質(zhì)肺炎副作用的比例仍然很高�。Enhertu可謂是已上市ADC藥物中研發(fā)管線布局最廣的藥物,在乳腺癌����、胃癌、結(jié)腸癌�����、肺癌等多個領(lǐng)域都展現(xiàn)出顯著的治療潛力���,被稱為抗癌“神藥”���。目前,Enhertu用于HER2陽性不可切除或轉(zhuǎn)移性乳腺癌三線及以上; HER2突變的胃或胃食管交界腺癌二線治療已經(jīng)獲得FDA批準�����?!蹲匀弧冯s志預(yù)測�,該產(chǎn)品預(yù)計到2026年�,將以62億美元的銷售額成為最暢銷的ADC藥物。第一三共與阿斯利康對ADC產(chǎn)品的研發(fā)充滿熱情和信心��,已經(jīng)開啟了ADC藥物之間的對決��。在2021年8月����,第一三共與伙伴阿斯利康,宣布其全球頭對頭III期臨床試驗DESTINY-Breast 03中獲得了陽性結(jié)果�����。這是抗HER2的ADC藥物間的第一次對決��,讓T-DXd一舉成為HER2陽性晚期乳腺癌二線治療的新標準�。作為新一代ADC藥物最重磅的明星產(chǎn)品�,二線治療標準并不是T-DXd的終點。第一三共希望通過一系列在乳腺癌領(lǐng)域的臨床研究�����,全面確立T-DXd 在HER2 陽性乳腺癌治療的王者地位����。 例如��,通過DESTINY-Breast 09研究向一線HER2陽性轉(zhuǎn)移性乳腺癌標準治療發(fā)起挑戰(zhàn)����;DESTINY-Breast 05 和11 二個研究則分別對照HER2陽性早期乳腺癌輔助及新輔助的標準治療��。同時�����,第一三共�����,也對TROP2的ADC Dato-DXd充滿信心��,希望將其打造成HER2靶點外乳腺癌的首選ADC藥物��。對于ADC產(chǎn)品的未來��,《自然》曾預(yù)測���,2020年前上市的10款A(yù)DC藥物�����,2026年將在全球創(chuàng)造出超過164億美元的市場��。但是當商業(yè)化的理想照到現(xiàn)實�����,截至2021年末����,全球已經(jīng)上市的14款A(yù)DC藥物中,僅有兩款A(yù)DC產(chǎn)品銷售額超過了10億美元���,多款產(chǎn)品的銷售業(yè)績?nèi)圆蛔?億美元�����。其中被稱為商業(yè)化最成功的產(chǎn)品2021年銷售額為21億美元,而該產(chǎn)品已經(jīng)上市近10年����。創(chuàng)新藥企和國內(nèi)大藥企似乎站到了同一起跑線上����。無論是大藥企恒瑞�����、石藥�����,還是科倫��、華東�����,均已有布局���,創(chuàng)新藥企也在這一賽道上耕耘了頗多時日�。從創(chuàng)新藥企陣營來看����,以榮昌生物生物為領(lǐng)頭羊�,樂普生物�、多禧生物、科倫博泰均表現(xiàn)不凡�。榮昌生物的產(chǎn)品管線中,擁有7款A(yù)DC產(chǎn)品����,靶點分布在HER2、間皮素���、c-MET����、Claudin 18.2等�,其中RC48已上市。樂普生物產(chǎn)品管線中�,已有5款A(yù)DC產(chǎn)品,且已經(jīng)進入臨床階段���。樂普生物成立于2018年,一舉收購ADC大戶美雅珂��,成為國內(nèi)ADC行業(yè)的佼佼者���,已有5條ADC產(chǎn)品管線�����。而科倫子公司�,科倫博泰主要聚焦于ADC藥物的研發(fā),目前已披露的ADC 產(chǎn)品有3款���,均為第三代ADC藥物��。值得關(guān)注的是�,這家成立于2012年的多禧生物��,也有望在激烈的ADC競爭中突圍����。多禧生物,是專門針對于ADC藥物研發(fā)的biotech公司�,該公司聚焦獨立技術(shù)平臺和開發(fā)新靶點能力這兩大藥物上市的突圍“殺器”。公開信息顯示�,多禧生物擁有不同階段的17條產(chǎn)品管線,具備自主知識產(chǎn)權(quán)的連接子���、毒性分子����、抗體工程技術(shù)平臺,聚焦腫瘤領(lǐng)域�����,開發(fā)了Her2�����、Trop2��、MUC1等靶點的創(chuàng)新ADC藥物����。2021年4月其MUC1 ADC藥物的臨床試驗申請獲得NMPA受理,是首個國產(chǎn)MUC1 ADC���。至2021年12月�,多禧生物已有4款A(yù)DC藥物獲批臨床����,并且該公司在2021年完成了10億元C輪融資。2019年多禧生物與君實生物達成合作,在授權(quán)許可區(qū)域內(nèi)負責 TROP2 靶向的DAC-002 后續(xù)的研發(fā)�����、注冊���、生產(chǎn)、銷售及其他商業(yè)活動����。2020年9月,該產(chǎn)品啟動I期臨床試驗����,招募153例晚期實體瘤患者。 大藥企中��,恒瑞與華東醫(yī)藥在ADC領(lǐng)域的布局相當積極�。恒瑞已有7款藥物處于不同研發(fā)階段。其靶向HER2的SHR-A1811進度最快�����,已進入II期臨床;此外���,6款藥物處于臨床I期 ���,包括SHR-A1201(Kadcyla類似物)����、SHR-A1403(靶向MET)�����。華東醫(yī)藥則在上周末���,剛剛完成一次大手筆的交易����。華東醫(yī)藥與德國Heidelberg Pharma公司達成合作協(xié)議���,華東醫(yī)藥獲得Heidelberg Pharma4款A(yù)DC新藥的亞洲權(quán)益(除日本外)����,協(xié)議總金額高達9.3億美元��。從已公開信息來看���,華東醫(yī)藥此次引進的分別為Heidelberg Pharma研發(fā)管線中的HDP-101���、HDP-102�、HDP-103和HDP-104�,以及另外2款待選擇的新藥�。具體來看,HDP-101靶向BCMA���,用于治療多發(fā)性骨髓瘤���;HDP-102靶向CD37,用于治療非霍奇金淋巴瘤���;HDP-103靶向PSMA��,用于治療前列腺癌���。這也是繼引進FRα靶點新藥IMGN853后,華東醫(yī)藥在ADC領(lǐng)域的又一布局���。授權(quán)引進確實是當前國內(nèi)ADC藥物賽道主要的方式���。從研究進度上來看����,國內(nèi)處于臨床后期(臨床III期及以上)的產(chǎn)品�,幾乎都以引進為主。中信證劵報告顯示���,截至 2021 年 12 月 29 日�����,國內(nèi)共有 74 個 ADC 藥物處于不同研 發(fā)階段�����。其中臨床I期占比最高(為35%)�,處于臨床后期(III期及以上)的產(chǎn)品共有17款����,其中本土企業(yè)申報的產(chǎn)品僅3款,該部分藥物主要由海外藥企開發(fā)�,多是海外已經(jīng)上市或進入臨床后期的產(chǎn)品。例如吉利德與云鼎新耀的戈沙妥組單抗�,在國內(nèi)處于申請上市階段����,齊魯制藥引進的KSI301���,華東醫(yī)藥引進自ImmunoGen的產(chǎn)品�,浙江醫(yī)藥引進自Ambrx的相關(guān)ADC產(chǎn)品均處于臨床三期階段���。除榮昌生物、東曜藥業(yè)�、百奧泰(已終止)的3款藥物為自主研發(fā)外,其余均由外企研發(fā)�。注:本文部分相關(guān)內(nèi)容參考自中信證券《群雄紛爭,ADC藥物領(lǐng)域快速發(fā)展》
文章來源:E藥經(jīng)理人