醫(yī)保談判之后�����,被稱為“孤兒藥”的諾西那生鈉注射液一夜之間就火了����。促使其“走紅”的原因有兩個�,一個是高興,另一個是驚訝���?����!案吲d”是因為70萬一針的天價藥諾西那生鈉�����,在進入醫(yī)保體系之后終于有了一個“親民”的價格�����,這將給更多的人帶來生的希望����。另一方面,諾西那生鈉等罕見病藥物的調入���,意味著近年來多方呼吁的高值罕見病藥納入醫(yī)保實現(xiàn)了零的突破�,這為未來更多罕見藥進入醫(yī)保體系釋放了積極的信號�。“驚訝”則是因為這種藥的售價居然是70萬一針,這極大地顛覆了大家對于藥價的認知��,不少網友甚至感嘆�,“這打一針的錢比我一輩子掙的錢還多!”��。更讓人感到窒息的是�,諾西那生鈉需要終身用藥,第一年打6針����,之后每4個月打1針,打就生效��,不打就無效�。這對于患者以及其家庭來說,真的很殘酷���,一邊是天價般的醫(yī)藥費����,一邊是可觸及的死亡����,不平衡的偏差之間開始產生了一種特殊的情緒,那就是對于藥企的“敵視”���,于是乎我們看到了諸如此類的熱評:“定價這么高����,藥企到底要賺多少錢啊,能不能為患者考慮一下����?”、“這么大的降價幅度都能接受,那證明藥企還是有利潤可賺����,之前肯定賺了很多錢了吧!”����、“藥物研發(fā)出來不就是給患者用的嗎,藥價定的這么高���,誰用得起啊���,藥企真是冒著良心賺錢?���!?/strong>但事實真的如此嗎?是�����,但又不完全是���。
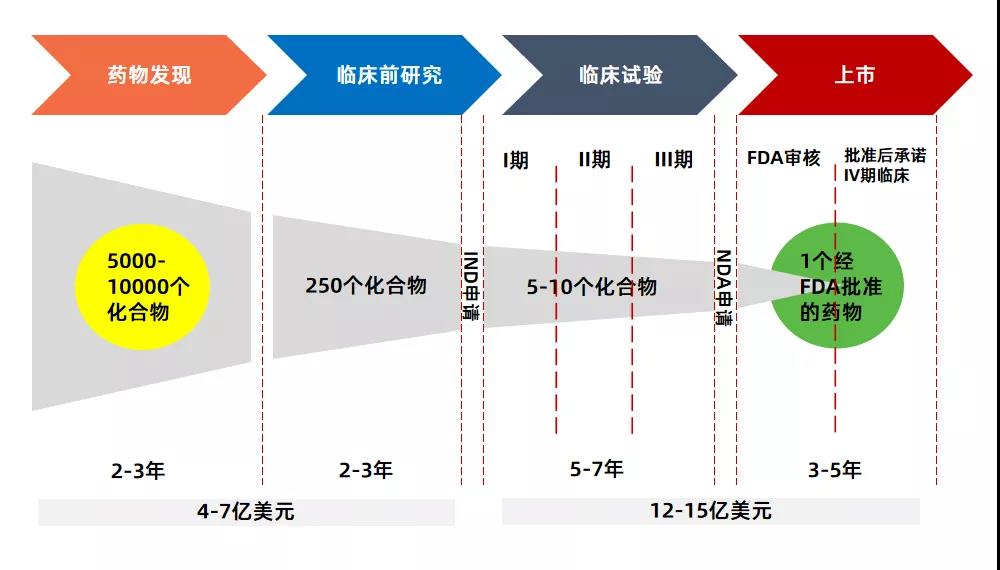
如何定義“孤兒藥”��,官方給出了三個詞�,分別是患病人群少�����、市場需求少和研發(fā)成本高��,別小看了這三個詞��,它幾乎道盡了“孤兒藥”研發(fā)的辛酸��。眾所周知�,新藥研發(fā)是一個重體力活,除了要有核心技術之外����,還需要有足夠的時間和資本。根據目前的研究結果顯示����,一款“First-in-class”新藥的研發(fā)成本(包含失敗研發(fā)管線的平均成本)大約在10億到20億美元之間。
而在研發(fā)時間上�,則需要10到15年,主要會經歷藥物發(fā)現(xiàn)�、臨床前研究、臨床試驗、上市四個關鍵階段�。其中,第三階段“臨床試驗”最為耗時���,一般需要5到7年���。這還是站在藥物研發(fā)成功的基礎上,如果失敗了����,一切都將付諸東流。根據數據統(tǒng)計���,全球范圍內����,新藥研發(fā)臨床I��、II��、III期的平均成功率分別為63.2%�、30.7%和58.1%,按照這個比例計算�����,從I期到上市,創(chuàng)新藥臨床研究的成功率不到10%�。創(chuàng)新藥尚且如此,不受人待見的“孤兒藥”在研發(fā)上只會更加艱難����。首先從技術上來講�,“孤兒藥”的臨床研究和入組面臨著極大挑戰(zhàn)。患者數據是對疾病開展針對性研究的基礎���,但“孤兒藥”卻在這方面顯得“捉襟見肘”��。一方面����,治療靶點的研究受制于孤兒病的發(fā)病機制研究不足�����、樣本數量不足�����,所以臨床研究的耗時很長,而且實驗的終點設置難度較大����;另一方面,患病人群少也使得臨床實驗的招募和入組比較困難����。這些“苛刻條件”幾乎在初期就磨滅了研發(fā)人員對于“孤兒藥”的熱情。一位醫(yī)學教授向動脈橙果局透露���,“醫(yī)生根本不愿意參加孤兒藥相關的研究����,因為一年可能也就碰到一兩個病人��,臨床數據根本就支撐不起研究�,花這個時間還不如去研究癌癥或者經費更多的病種。”其次從投入上來講�,漫長的時間和高額的成本足以逼退很多人?�!肮聝核帯庇捎诨疾∪藬瞪?��、研究資料缺乏�����、受試者難以尋找���、致病機理復雜等原因�,整體成本比一般創(chuàng)新藥物研發(fā)要投入的更多��。以電影《我不是藥神》中的白血病神藥格列衛(wèi)為例���,諾華制藥整整花了41年,總投入14億美元才得以研發(fā)成功�����。最后從回報上來講�,專利保護期使藥企在獲利上有了期限。對于藥企來說�����,研發(fā)一款孤兒藥先別想著賺錢����,收回成本都很難�。一方面是定價的問題�,太低收不回成本,太高又找不到支付方���,很容易出現(xiàn)爭議�����;另一方面是市場體量的問題����,孤兒病患者數量有限��,而且由于藥價昂貴����,如果沒有一個好的支付體系,真正能支付的微乎其微��。但最致命的還是專利保護期的問題����。假如能鎖定現(xiàn)在甚至將來所有病人只使用該藥企研發(fā)的藥物,那么收回成本只是時間問題�����。但是,由于專利已經公開��,一旦過了保護期�����,其他制藥企業(yè)就可以免費分享這一成果��,并能依靠更低的價格迅速占據市場份額���。到那時候�,原研藥企就沒有任何競爭力了�����,收益必然會出現(xiàn)“斷崖式”下跌�����。所以��,從某種程度上來講���,研發(fā)“孤兒藥”真的是一個吃力不討好的事情���。一方面,藥企花了很大精力去做沒有人愿意做的事情�,這本身就是一個挑戰(zhàn);另一方面�,藥企做成功之后還要去平衡市場,如果定價高了����,會落得“黑心企業(yè)”的臭名,如果定價低了��,在專利保護期內又很難收回成本����,最后只能賠本賺吆喝。
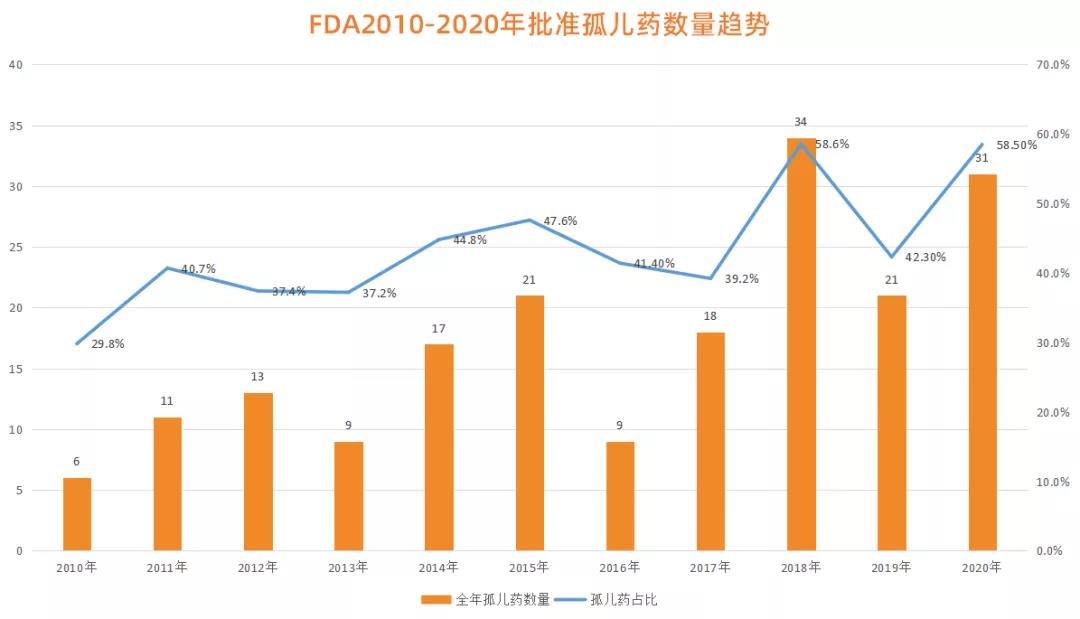
研發(fā)“孤兒藥”很難����,所以更需要有人站出來。但在這一點上����,我們應該持有一個理性的認識:藥企不是慈善機構��,他們需要盈利����,因為只有這樣���,他們才能維持企業(yè)的正常發(fā)展��,才能投入更多的精力去創(chuàng)新�����,畢竟任何一款“孤兒藥”都不是從天上掉下來的��,而是藥企用巨額的研發(fā)成本和研發(fā)時間換來的���。所以,如何讓更多藥企“站”出來去研發(fā)“孤兒藥”是我們現(xiàn)階段需要解決的問題�。近年來��,隨著技術的不斷發(fā)展以及整體研發(fā)環(huán)境的改善���,全球越來越多地藥企開始投身于“孤兒藥”的研發(fā)��。圖2 | FDA2010-2020年批準孤兒藥數量趨勢
這一點在美國FDA批準的新藥中得到了驗證���。據統(tǒng)計���,在2010年到2020年期間,F(xiàn)DA批準的“孤兒藥”數量呈現(xiàn)穩(wěn)步上升的趨勢���。2010年����,F(xiàn)DA批準的孤兒藥數量僅有6個����,而這一數值到2018年已達到了34個。在2020年�,F(xiàn)DA批準的孤兒藥數量為31個,占全年獲批新藥總數的58.5%�,比值達到了10年來的新高。除了數量的激增���,研發(fā)成功率也在快速提升����。根據最新發(fā)布的一份藥物臨床開發(fā)成功率報告顯示,在2011年到2020年����,孤兒藥(不含腫瘤適應癥)從1期臨床到獲得美國FDA批準上市的平均成功率為17%,高于整體藥物的平均開發(fā)成功率7.9%���。但這些快樂都是別人的��,因為到目前為止���,中國有關“孤兒藥”的研發(fā)成果幾乎是一片空白。這其中的原因很多也很復雜���,比如技術上的問題�、研發(fā)成本的問題����、藥物審批的問題、專利保護的問題����、市場定價的問題、藥物支付的問題等等�����,這些痛點在時間的演變中逐漸形成一種合力���,在中國孤兒藥市場上打了一個“死結”����。但這并不代表沒有解決方法����,推動孤兒藥研發(fā)最有效的方式就是建立一套成熟有效的激勵政策。以美國為例��。1983年之前��,美國上市的孤兒藥只有38種���,但從1983年《孤兒藥法案》頒布至今����,已有500多種孤兒藥被新批準上市��。《孤兒藥法案》的頒布為美國原本死氣沉沉的孤兒藥研發(fā)領域注入了全新的生機與活力。這個《孤兒藥法案》為何如此奏效呢��?這主要歸功于法案所包含的四個主要經濟激勵措施��。一是孤兒藥一旦通過FDA認定����,即可獲得7年的市場獨占權,在這7年里��,F(xiàn)DA將不再批準針對相同適應癥的新藥上市��,除非這款新藥被證明比先前的藥物更有效��,在沒有競爭對手�、處于壟斷地位的情況下,藥企就可以收獲相當可觀的經濟回報��,該獨占權被認為是最強有力的激勵手段��。另外三個分別是給予孤兒藥特殊的稅費優(yōu)惠���、向孤兒藥公司提供開發(fā)補助及研究基金和FDA為孤兒藥公司提供臨床試驗的咨詢與協(xié)助���。這些措施在為藥企減輕研發(fā)成本的同時����,也解決了藥企在研發(fā)之中所遇到的各種難題��,這對于提高研發(fā)成功率有很大幫助��。一名國內藥企高管在采訪中告訴動脈網����,“并非不是我們不愿意去研發(fā)孤兒藥���,主要是它臨床試驗難度很大�����,投入的成本又很高��,如果沒有資金和政策的支持�,根本沒有企業(yè)有勇氣����、有能力去做這樣的事情。”這完全能夠理解����,畢竟藥企終歸是需要盈利的����,即便是再有人文關懷�����,在巨大的經濟壓力面前�����,也不可能完全“用愛發(fā)電”����,只靠情懷必然是行不通的。換一個角度講���,任何事物的正向發(fā)展都需要建立在一個平衡的體系�,如果有一方重了或輕了����,合作就很難再進行下去。因此,在孤兒藥的研發(fā)上�,藥企不應該被片面地敵視,而是需要真正的激勵����。
當前�����,我國孤兒藥長期依賴進口����,但這并不是長久之計�。一方面,在醫(yī)藥領域�,沒有核心技術就等于沒有話語權,國內“孤兒病”患者會非常被動����;另一方面,我國“孤兒病”患者數量正在激增���,根據數據顯示��,我國目前“孤兒病”患者人數約為2000萬���,其中50%為兒童���,每年新增“孤兒病”病例超過20萬。所以我們需要在“孤兒藥”上實現(xiàn)“國產替代”����。站在這一目標之上,一些積極的信號正在釋放��。
首先在政策端���,相關政府部門針對性地出臺了一系列“孤兒病”利好政策��,包括優(yōu)化審評審批�����、臨床試驗數據和知識產權保護等���,多項政策的落實在為國內藥企掃清研發(fā)障礙的同時,也增強了國內藥企加大對孤兒藥研發(fā)投入的信心����。其次在支付端��,“孤兒病”患者可以享受的保障方式開始趨向多元化�����,在剛剛結束的醫(yī)保談判中����,共有7款“孤兒病”用藥進入醫(yī)保�����。特別值得一提的是����,這是國內首次高值“孤兒藥”納入醫(yī)保體系��。除此之外�,地方也在積極探索不同的“孤兒病”保障模式,諸如“惠蓉?!薄八霘q康”等在內,多地陸續(xù)落地“惠民?��!边@一普惠型商業(yè)補充醫(yī)療保險�����,覆蓋了部分“孤兒病”藥物���,這在一定程度上為“孤兒病”群體提供了保障�。最后在企業(yè)端�,當前,市場上已誕生了像北?�?党?�、應諾醫(yī)藥�、北京科信必成等專注于孤兒病用藥的國有研發(fā)企業(yè),其中國內孤兒藥先行者北?���?党?/strong>已于今年12月10日在港交所上市,這讓藥企甚至資本看到了孤兒藥研發(fā)在中國的成功路徑和市場前景����。根據數據顯示,我國“孤兒藥”市場規(guī)模預計5到10年內會突破100億美元�����,這無疑是一片巨大的藍海市場,但想要上岸���,還需要這條創(chuàng)新生態(tài)鏈上的每一個參與方的努力���。尤其是藥企,他們是創(chuàng)新的起源����,需要肩負起更多的責任,但同時也應該得到與其付出相匹配的回報�,這是一種雙贏的選擇。只有這樣��,才能推動更多孤兒藥走向市場����,才能讓更多的人有生的希望��,才能真正實現(xiàn)“不放棄每一個小群體”���。
文章來源:動脈橙果局