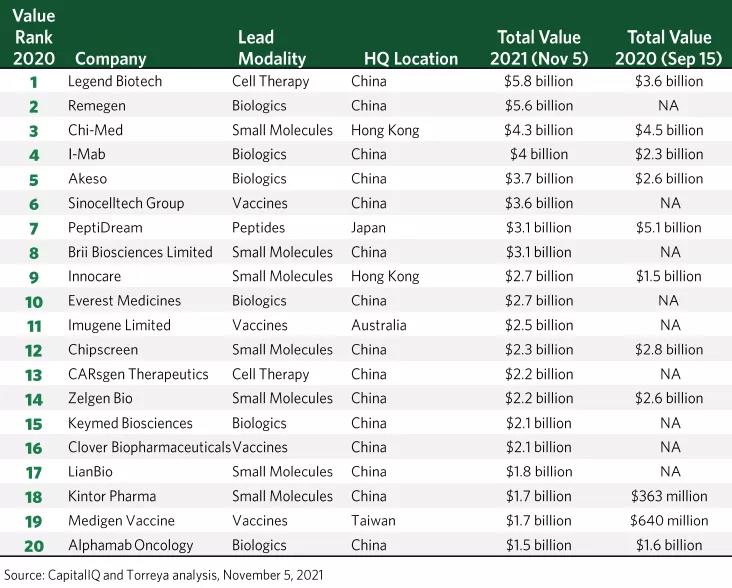
近日,全球知名投行Torreya發(fā)布了《全球1000強(qiáng)藥企報(bào)告》,按估值對全球前1000家藥企(Pharma)進(jìn)行了排名��,Torreya還對亞洲生物醫(yī)藥(Biotech)公司估值進(jìn)行了排名�����,評(píng)選出了前20強(qiáng)。值得一提的是,這20強(qiáng)生物醫(yī)藥公司中的18家來自中國(含港澳臺(tái)地區(qū))�,前5強(qiáng)均為中國公司�����,前10強(qiáng)中9家為中國公司��。本文精選其中5家生物醫(yī)藥公司進(jìn)行相關(guān)介紹�����。榮昌生物成立于2008年�����,總部位于中國山東煙臺(tái)�,致力于研發(fā)針對自身免疫、腫瘤和眼科疾病的生物藥,公司聯(lián)合創(chuàng)始人����、首席執(zhí)行官兼首席科學(xué)官為房健民博士。自成立以來���,該公司已搭建了三大核心技術(shù)平臺(tái)�,分別是抗體和融合蛋白平臺(tái)�、抗體偶聯(lián)藥物(ADC)平臺(tái)以及雙功能抗體平臺(tái)����。去年11月�����,榮昌生物正式在港交所上市;今年6月�,榮昌生物在科創(chuàng)板遞交首次公開募股(IPO)申請并獲得受理;今年8月,榮昌生物與Seagen達(dá)成一項(xiàng)總額最高達(dá)26億美元的全球獨(dú)家許可協(xié)議�,共同開發(fā)和推廣榮昌生物自主開發(fā)的創(chuàng)新抗體偶聯(lián)藥物(ADC)維迪西妥單抗(disitamab vedotin)����。目前����,榮昌生物建立了包含十余種創(chuàng)新藥物的研發(fā)管線。在適應(yīng)癥方面,這些在研產(chǎn)品覆蓋了胰腺癌����、肺癌、尿路上皮癌等多種實(shí)體瘤,以及濕性老年黃斑病變(wAMD)��、糖尿病黃斑水腫(DME)等���。其核心產(chǎn)品泰它西普以及維迪西妥單抗分別于今年3月和今年6月經(jīng)優(yōu)先審評(píng)審批程序在中國獲附條件批準(zhǔn)上市�,分別用于治療系統(tǒng)性紅斑狼瘡和胃癌��。公開資料顯示�,維迪西妥單抗是首款由中國公司自主研發(fā)并獲批上市的ADC�����。天境生物成立于2016年�,總部位于中國上海���,是一家處于臨床階段的創(chuàng)新生物藥公司��,聚焦腫瘤免疫治療和自身免疫疾病領(lǐng)域創(chuàng)新生物藥的早期發(fā)現(xiàn)�����、藥物開發(fā)和商業(yè)化����,以填補(bǔ)尚未滿足的重大醫(yī)療需求�。天境生物已搭建四大抗體工程平臺(tái)��,包括抗體細(xì)胞因子平臺(tái)����、雙特異性平臺(tái)��、長效hyFc蛋白平臺(tái)和單克隆抗體平臺(tái)�,基于此設(shè)計(jì)具有特定生物學(xué)特性的藥物分子。去年1月��,天境生物正式登陸納斯達(dá)克����;去年9月,天境生物與艾伯維達(dá)成近30億美元合作�,共同開發(fā)和商業(yè)化其在研抗癌藥物——CD47單克隆抗體lemzoparlimab(TJC4);今年11月�,天境生物與濟(jì)川藥業(yè)達(dá)成超20億元合作���,開發(fā)和商業(yè)化伊坦生長激素(eftansomatropin alfa)�����。目前��,天境生物已搭建了十余條在研管線�,其中1項(xiàng)將申報(bào)上市�����,2項(xiàng)正在進(jìn)行注冊性3期臨床試驗(yàn)����,7項(xiàng)正在進(jìn)行2期臨床試驗(yàn)��,8項(xiàng)正在進(jìn)行1期臨床試驗(yàn)�����,適應(yīng)癥涵蓋多發(fā)性骨髓瘤���、膠質(zhì)母細(xì)胞瘤���、兒童生長激素缺乏癥等�。其先導(dǎo)候選藥物TJ202是一款差異化CD38抗體�,擬用于治療多發(fā)性骨髓瘤和系統(tǒng)性紅斑狼瘡等。該藥是天境生物現(xiàn)有研發(fā)管線中首個(gè)即將達(dá)到注冊性臨床試驗(yàn)終點(diǎn)的產(chǎn)品����,適用于多發(fā)性骨髓瘤的三線治療���,預(yù)計(jì)于今年第四季度在中國提交新藥上市申請�����。伊坦生長激素是一款差異化長效重組人生長激素���,擬用于治療兒童生長激素缺乏癥��。今年2月,伊坦生長激素完成中國注冊性3期臨床試驗(yàn)的首例患者給藥��,預(yù)計(jì)將于2023年提交新藥上市申請。康方生物成立于2012年,總部位于中國廣東�����,是一家創(chuàng)新型生物醫(yī)藥公司�,致力于發(fā)現(xiàn)和開發(fā)具有自主知識(shí)產(chǎn)權(quán)的創(chuàng)新型抗體新藥�����,以滿足全球醫(yī)藥市場的需求���。康方生物已建成生物醫(yī)藥全程研發(fā)及產(chǎn)業(yè)化平臺(tái),建立了針對腫瘤�、自身免疫性疾病、炎癥和心血管疾病的產(chǎn)品線���。去年4月���,康方生物正式在港交所上市�,實(shí)現(xiàn)了約639.2倍的超額認(rèn)購���,為2020年港股募資第一名���。值得一提的是,這是康方生物第二次入選“亞洲最具價(jià)值TOP20生物醫(yī)藥公司”榜單。目前,康方生物建立了20多個(gè)創(chuàng)新抗體藥物開發(fā)項(xiàng)目���,其中9個(gè)抗體處于臨床階段����,6個(gè)雙特異性抗體(兩個(gè)處于臨床階段)及5個(gè)抗體獲得FDA的新藥臨床試驗(yàn)(IND)申請批準(zhǔn)。在適應(yīng)癥方面����,這些在研產(chǎn)品覆蓋了非小細(xì)胞肺癌、肝癌�����、胃癌�����、宮頸癌等實(shí)體瘤和血液瘤���,系統(tǒng)性紅斑狼瘡、銀屑病等自身免疫性疾病和其他。康方生物潛在“first-in-class”的PD-1/CTLA-4雙特異性抗體凱得寧單抗治療宮頸癌的上市申請已經(jīng)獲得中國國家藥品監(jiān)督管理局(NMPA)受理��,并獲優(yōu)先審評(píng)����。根據(jù)新聞稿�����,這意味著���,凱得寧單抗成為全球第一個(gè)遞交上市申請的基于PD-1的雙特異性抗體藥物���。另外,該公司自主研發(fā)的差異化PD-1單克隆抗體藥物安尼可(派安普利單抗)已于今年8月在中國正式獲批上市��,治療霍奇金淋巴瘤�����;同時(shí)�����,派安普利在中國治療鱗狀非小細(xì)胞肺癌和鼻咽癌��、在美國治療鼻咽癌的上市申請均已經(jīng)成功遞交。諾誠健華成立于2015年�,總部位于中國北京,是一家商業(yè)化階段的生物醫(yī)藥公司����,專注于惡性腫瘤及自身免疫性疾病治療領(lǐng)域的一類新藥研發(fā)��,適用于治療中國病人高發(fā)的淋巴瘤�����、肝癌�����、膽管癌、尿路上皮癌等多種惡性腫瘤及自身免疫性疾病��。該公司目前已搭建了完整的研發(fā)平臺(tái)��,覆蓋從藥物發(fā)現(xiàn)到臨床開發(fā)的全研發(fā)鏈條。去年3月�����,諾誠健華正式在港交所上市�;今年3月�����,諾誠健華發(fā)布公告擬赴科創(chuàng)板上市����。今年10月��,諾誠健華科創(chuàng)板IPO獲問詢,有望登陸上交所科創(chuàng)板����。諾誠健華產(chǎn)品管線已深度布局血液瘤����、實(shí)體瘤和自身免疫性疾病領(lǐng)域��,快速推進(jìn)源頭創(chuàng)新和全球臨床試驗(yàn)���。去年12月,諾誠健華研發(fā)的BTK抑制劑奧布替尼正式獲得中國NMPA批準(zhǔn)上市��,用于套細(xì)胞淋巴瘤(MCL)和慢性淋巴細(xì)胞白血?���。–LL)/小淋巴細(xì)胞淋巴瘤(SLL)��。這是該公司首款獲批上市的創(chuàng)新藥�,標(biāo)志著公司從臨床開發(fā)全面進(jìn)入商業(yè)化階段�。另外,諾誠健華還有4款在美國獲批臨床的創(chuàng)新藥���,最新獲批的為新型蛋白酪氨酸磷酸酶SHP2變構(gòu)抑制劑ICP-189����。同時(shí),該公司的還有多款創(chuàng)新藥在中國獲批臨床���,包括CD20xCD3雙特異性抗體CM355����、新型多靶點(diǎn)受體酪氨酸激酶(RTK)抑制劑ICP-033等����。5.科濟(jì)藥業(yè)(CARsgen Therapeutics)科濟(jì)藥業(yè)成立于2014年���,總部位于上海���,是一家聚焦于CAR-T細(xì)胞����、抗體等腫瘤免疫治療藥物的創(chuàng)新型生物醫(yī)藥企業(yè)。自成立以來���,科濟(jì)藥業(yè)已內(nèi)部開發(fā)多項(xiàng)新技術(shù)以及擁有全球權(quán)益的產(chǎn)品管線,以解決CAR-T細(xì)胞療法面臨的重大挑戰(zhàn)��,比如提高安全性���、提高實(shí)體瘤的療效等�����。就CAR-T細(xì)胞療法而言���,科濟(jì)藥業(yè)已經(jīng)在中國���、美國�、加拿大獲得一共7個(gè)IND批件�����。去年11月,科濟(jì)藥業(yè)宣布完成了由正心谷資本領(lǐng)投的1.86億美元C輪融資;今年6月���,科濟(jì)藥業(yè)正式在港交所上市��;今年7月���,科濟(jì)藥業(yè)完成了兩款CAR-T候選產(chǎn)品的對外授權(quán)��。目前���,科濟(jì)藥業(yè)已布局了十余條在研管線,適應(yīng)癥涵蓋多發(fā)性骨髓瘤���、胃癌/胰腺癌��、干細(xì)胞癌等�����。該公司針對CLDN18.2的自體CAR-T候選產(chǎn)品CT041目前已獲得美國FDA�����、中國NMPA和加拿大衛(wèi)生部批準(zhǔn)進(jìn)行臨床試驗(yàn)�����。CT041曾于去年獲得美國FDA授予的孤兒藥資格(ODD)��,用于治療胃癌/胃食管結(jié)合部癌�����。今年���,CT041又先后被歐洲藥品管理局(EMA)授予孤兒藥資格和優(yōu)先藥品(PRIME)資格�,用于治療胃癌。根據(jù)新聞稿介紹���,CT041是全球首個(gè)入選PRIME計(jì)劃的實(shí)體瘤CAR-T產(chǎn)品���。下表為全球知名投行Torreya于2021年11月5日發(fā)布的亞洲最具價(jià)值TOP20生物醫(yī)藥公司��,摘自《全球1000強(qiáng)藥企報(bào)告》����。▲亞洲最具價(jià)值TOP20生物醫(yī)藥公司(20 Most Valuable Biotechs in Asia)榜單——Torreya,2021年11月5日
文章來源:創(chuàng)鑒匯