“雙十一”,萬(wàn)眾矚目的2021年國(guó)家醫(yī)保談判謝幕���,再次引發(fā)全社會(huì)對(duì)于創(chuàng)新藥的高度關(guān)注�����。近幾年��,新醫(yī)改大背景下的中國(guó)創(chuàng)新藥產(chǎn)業(yè)如火如荼�����,那么產(chǎn)業(yè)發(fā)展情況究竟如何�?對(duì)此,伴隨而起的各家商用醫(yī)藥數(shù)據(jù)庫(kù)紛紛給出自己的答案��。然而,美中不足的是�����,創(chuàng)新藥領(lǐng)域相對(duì)缺乏官宣的權(quán)威數(shù)據(jù)����。有鑒于此,國(guó)家藥監(jiān)局藥審中心在11月10日發(fā)布了《中國(guó)新藥注冊(cè)臨床試驗(yàn)現(xiàn)狀年度報(bào)告(2020年)》(下稱(chēng)“報(bào)告”)����,基于自有的藥物臨床試驗(yàn)登記與信息公示平臺(tái)(chinadrugtrials.org.cn),首次對(duì)中國(guó)新藥注冊(cè)臨床試驗(yàn)現(xiàn)狀進(jìn)行全面匯總分析�。雖然報(bào)告標(biāo)題為“中國(guó)新藥注冊(cè)臨床試驗(yàn)”,但CDE的藥物臨床試驗(yàn)平臺(tái)包含了各類(lèi)型藥物的臨床試驗(yàn)���,報(bào)告相應(yīng)地統(tǒng)計(jì)分析了相關(guān)數(shù)據(jù)��。2020年共登記臨床試驗(yàn)2602項(xiàng)�����,相比2019年總體增長(zhǎng)9.1%���。按創(chuàng)新屬性區(qū)分����,新藥(創(chuàng)新藥+改良型新藥)的臨床試驗(yàn)登記1473項(xiàng)�,超過(guò)了仿制藥的1129項(xiàng)。這是否說(shuō)明新藥數(shù)量多于仿制藥了呢�?一方面�����,通常新藥針對(duì)單個(gè)適應(yīng)癥需進(jìn)行I~III期臨床試驗(yàn)�����,如有多個(gè)適應(yīng)癥���,那么需進(jìn)行的試驗(yàn)數(shù)量更多��;而仿制藥通常只進(jìn)行一個(gè)生物等效性試驗(yàn)(BE)用于一致性評(píng)價(jià)��,僅有少數(shù)需要進(jìn)行驗(yàn)證性試驗(yàn)��。另一方面�,國(guó)家藥品集采已經(jīng)執(zhí)行了五批��,常用的主要仿制藥品種已經(jīng)納入,所剩不多����。因此,僅從登記試驗(yàn)數(shù)量���,不能斷定新藥的數(shù)量多于仿制藥�����。然而�,這反映了中國(guó)新藥研發(fā)頗具活力����,創(chuàng)新轉(zhuǎn)型已經(jīng)成為企業(yè)共識(shí)。新藥臨床試驗(yàn)申辦者����、藥物類(lèi)型
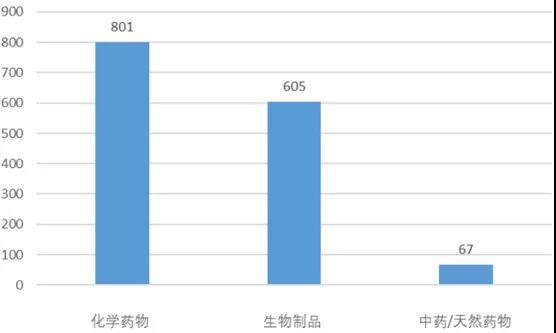
根據(jù)臨床試驗(yàn)申請(qǐng)受理號(hào)區(qū)分,基于進(jìn)口臨床申請(qǐng)的試驗(yàn)由國(guó)外企業(yè)(sponsor)申辦���,其他為國(guó)內(nèi)企業(yè)申辦�。新藥臨床試驗(yàn)有1142項(xiàng)由國(guó)內(nèi)企業(yè)申辦��,331項(xiàng)由國(guó)外企業(yè)申辦,接近4:1�����。其中�,國(guó)外企業(yè)申辦的新藥臨床試驗(yàn)中包括208項(xiàng)國(guó)際多中心試驗(yàn)(MRCT),123項(xiàng)國(guó)內(nèi)試驗(yàn)�����。按藥物類(lèi)型區(qū)分�����,在2020年登記的全部2602項(xiàng)臨床試驗(yàn)中化學(xué)藥�����、生物制品��、中藥的占比分別為73.6%����、23.8%和2.6%��。化學(xué)藥占比最高一方面是中國(guó)制藥業(yè)仍基于傳統(tǒng)的化學(xué)合成����,另一方面是仿制藥除了少量中藥仿制藥,絕大部分為化藥仿制藥�����。在2020年登記的1473項(xiàng)新藥臨床試驗(yàn)中����,化學(xué)藥、生物制品��、中藥分別登記了801項(xiàng)����、605項(xiàng)和67項(xiàng)。這反映了新藥領(lǐng)域中�,生物創(chuàng)新藥發(fā)展迅猛,PD-(L)1的激烈競(jìng)爭(zhēng)即為一個(gè)縮影�����。圖表1. 2020年登記的新藥臨床試驗(yàn)的藥物類(lèi)型劃分來(lái)源:CDE�,中康產(chǎn)業(yè)資本研究中心
臨床試驗(yàn)top10品種����、靶點(diǎn)
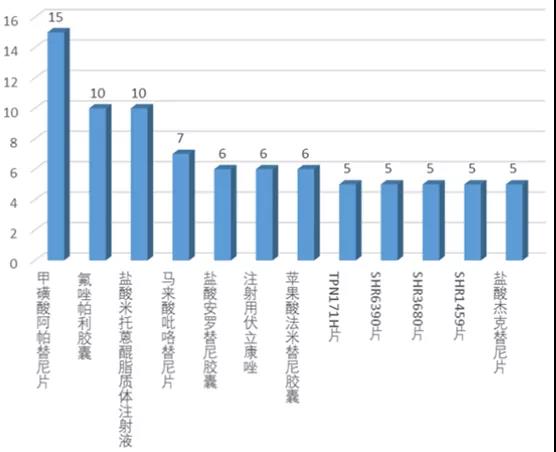
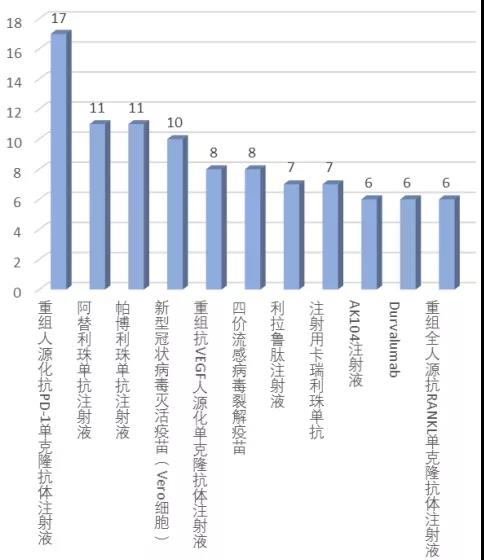
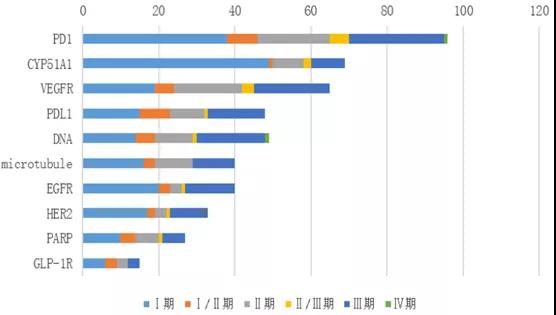
在化學(xué)藥臨床試驗(yàn)(扣除生物等效性試驗(yàn))中�,登記試驗(yàn)數(shù)量前10的品種基本為抗腫瘤藥物,其中恒瑞醫(yī)藥的甲磺酸阿帕替尼片以15項(xiàng)居首����,主要為與其他藥物聯(lián)用的臨床試驗(yàn)。在Top10化藥新藥中���,恒瑞醫(yī)藥獨(dú)占7個(gè):阿帕替尼����、氟唑帕利�����、吡咯替尼�、法米替尼��、SHR6309����、SHR3680�����、SHR1459�����。這體現(xiàn)了“創(chuàng)新藥一哥”的強(qiáng)大實(shí)力��,也從側(cè)面反映了恒瑞醫(yī)藥在2020年進(jìn)一步加快研發(fā)進(jìn)度���。圖表2. 非BE臨床試驗(yàn)數(shù)量top10化學(xué)藥來(lái)源:CDE,中康產(chǎn)業(yè)資本研究中心在生物制品中���,登記臨床試驗(yàn)數(shù)量前10位的品種包括8個(gè)治療用生物制品和2個(gè)預(yù)防用生物制品(疫苗)����。以“重組人源化抗PD-1單克隆抗體注射液”為藥物名稱(chēng)登記的臨床試驗(yàn)多達(dá)17項(xiàng)���,申辦者包括君實(shí)生物(5項(xiàng))��、康方生物(5項(xiàng))����、新時(shí)代藥業(yè)(4項(xiàng))、神州細(xì)胞(1項(xiàng))和麗珠單抗(1項(xiàng))�。此外,阿斯利康的T藥(阿替利珠單抗)��、默沙東的K藥(帕博利珠單抗)�、恒瑞醫(yī)藥的卡瑞利珠單抗、阿斯利康的I藥(Durvalumab)分別登記了11項(xiàng)�����、11項(xiàng)����、7項(xiàng)和6項(xiàng)臨床試驗(yàn)。預(yù)防用生物制品中��,新冠滅活疫苗(Vero細(xì)胞)和四價(jià)流感病毒裂解疫苗分別登記了10項(xiàng)和8項(xiàng)臨床試驗(yàn)�。圖表3. 登記臨床試驗(yàn)數(shù)量top10的生物制品來(lái)源:CDE����,中康產(chǎn)業(yè)資本研究中心登記試驗(yàn)數(shù)量top10的靶點(diǎn)依次為PD-1、CYP51A1�����、VEGFR、PD-L1�����、DNA��、微管����、EGFR、HER2����、PARP、GLP-1R�����,其中前三個(gè)靶點(diǎn)登記的試驗(yàn)數(shù)量均超過(guò)了60項(xiàng)�。除了GLP-1R與糖尿病治療相關(guān),其他9個(gè)靶點(diǎn)集中在腫瘤治療領(lǐng)域��。II期臨床試驗(yàn)在各靶點(diǎn)中的占比均較低��,試驗(yàn)階段在各靶點(diǎn)呈現(xiàn)兩極分化,這在某種程度上反映國(guó)內(nèi)新藥研發(fā)在進(jìn)度上已經(jīng)出現(xiàn)了梯隊(duì)分化���。靶點(diǎn)扎堆情況仍未明顯緩解�,表明國(guó)內(nèi)新藥研發(fā)仍然以仿創(chuàng)和快速跟進(jìn)為主���。在CDE發(fā)布《以臨床價(jià)值為導(dǎo)向的抗腫瘤藥物臨床研發(fā)指導(dǎo)原則》征求意見(jiàn)稿發(fā)布之后���,一些研發(fā)進(jìn)度較落后的項(xiàng)目將面臨著取舍。圖表4. 登記臨床試驗(yàn)數(shù)量top10靶點(diǎn)及試驗(yàn)分期來(lái)源:CDE���,中康產(chǎn)業(yè)資本研究中心

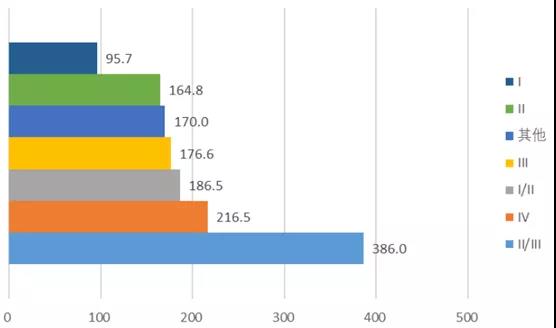
臨床試驗(yàn)申請(qǐng)獲批后6個(gè)月內(nèi)啟動(dòng)受試者招募的占比為24.9%���,1年內(nèi)啟動(dòng)招募的占比為45.4%。值得注意的是����,直至臨床試驗(yàn)批件3年有效期到期仍未啟動(dòng)招募的占比為19.8%,不論對(duì)于藥監(jiān)機(jī)構(gòu)還是企業(yè)�,這都是較大的資源浪費(fèi)。在1473項(xiàng)新藥臨床試驗(yàn)中�,2020年完成121項(xiàng)����,其中I期~IV期試驗(yàn)數(shù)量分別為93項(xiàng)�、10項(xiàng)�、5項(xiàng)和2項(xiàng),其他試驗(yàn)為11項(xiàng)��。根據(jù)登記的國(guó)內(nèi)試驗(yàn)完成日期和國(guó)內(nèi)首例知情同意(ICF)日期��,臨床試驗(yàn)完成時(shí)間范圍為6~735個(gè)自然日��,其中I期試驗(yàn)平均耗時(shí)95.7天�����,III期試驗(yàn)平均耗時(shí)176.6天��,II/III期序貫試驗(yàn)平均耗時(shí)386天���。圖表5. 2020年登記完成的臨床試驗(yàn)平均耗時(shí)來(lái)源:CDE���,中康產(chǎn)業(yè)資本研究中心

在1473項(xiàng)新藥臨床試驗(yàn)中,有1038項(xiàng)試驗(yàn)包括老年人受試者����,僅在老年人群中開(kāi)展的試驗(yàn)有3項(xiàng)�����。這可能因?yàn)樾滤幯邪l(fā)較集中的治療領(lǐng)域�����,如腫瘤��、自身免疫性疾病�����、內(nèi)分泌系統(tǒng)疾病的發(fā)病與年齡增長(zhǎng)相關(guān)�����,均包含了大量老年患者�。在兒童中開(kāi)展臨床試驗(yàn)不僅患者招募困難��,同時(shí)也要更加謹(jǐn)慎�����。在新藥臨床試驗(yàn)中�����,含兒童受試者的試驗(yàn)有129項(xiàng)(8.8%)�����,只在兒童中開(kāi)展的試驗(yàn)僅33項(xiàng)(2.2%)�����。按適應(yīng)癥劃分����,生物制品和化學(xué)藥主要為抗腫瘤藥、預(yù)防性疫苗�����、皮膚和五官科藥物��、抗感染藥物�,中藥/天然藥物為呼吸類(lèi)藥物和皮膚科藥物。官宣臨床試驗(yàn)?zāi)陥?bào)是藥監(jiān)局的又一次大膽嘗試����,在探索運(yùn)用信息化手段提升藥品監(jiān)管的道路繼續(xù)邁進(jìn)��。官方數(shù)據(jù)具有權(quán)威性����、準(zhǔn)確性�����,能夠?qū)κ袌?chǎng)上的商用數(shù)據(jù)起到正本清源的作用���。及時(shí)發(fā)布臨床試驗(yàn)信息����,能夠?yàn)樾滤幯邪l(fā)����、資源配置、藥品審評(píng)起到積極的引導(dǎo)作用�。希望未來(lái)藥監(jiān)局能夠堅(jiān)持,持續(xù)記錄中國(guó)創(chuàng)新藥產(chǎn)業(yè)進(jìn)展�。