國慶節(jié)日期間�����,一則關于默沙東的正研抗新冠肺炎口服藥物Molnupiravir(莫奈拉韋�,簡稱“莫藥”)的消息令大家激動不已����。特效藥誕生了? 以后治新冠病毒就像現(xiàn)在治療普通感冒一樣嗎? 新冠肺炎流行病離結束不遠了嗎?
然而��,節(jié)日剛過�,印度隨即傳來了該藥對于中度新冠患者“沒有顯著療效”的報道和信息,如同一瓢涼水澆在了我們頭上����。莫藥帶來的藥物療效,目前尚難定論�����。事實上����,根據疫苗研發(fā)的十大技術路徑和FDA批準的十個EUA產品���,抗擊疫情的每個環(huán)節(jié)都是組合拳�。目前,新冠肺炎的治療已上升為各先進醫(yī)藥國家的戰(zhàn)略問題, 埃格林醫(yī)藥抗炎新藥EG-009A正在通過六點開發(fā)戰(zhàn)略實現(xiàn)突破�����。為此�����,有媒體記者采訪了深圳埃格林醫(yī)藥有限公司的CMO李長青博士����,對于莫藥這一新藥帶來的變化,聚焦“抗擊新冠肺炎是需要 ‘組合拳’”這一話題���,李長青博士進行了深入的解析�����。莫藥適合人群���、服用時間����、還需確定的事件
可以確定的是��,莫藥的研發(fā)是人類抗擊新冠肺炎病毒史上的一項重大進步�。多個國家臨床III期的試驗分析發(fā)現(xiàn),在775名患有輕度或中度新冠肺炎疾病��、生病少于5 天��、冠狀病毒PCR檢測呈陽性的患者中�����,服用莫奈拉韋的患者在隨機分組后第29天住院或死亡率僅為7.3%����,其藥效令人滿意。然而�,來自印度的最新臨床研究結果表明, 莫奈拉韋對中度新冠疾病不是非常有效。印度藥品監(jiān)管機構內部專家委員會在其網站上披露���,根據兩家印度制藥商(Aurobindo和MSN)已提交的中期臨床試驗數據顯示����,莫奈拉韋沒有對中度新冠疾病患者展示出“顯著療效”,并要求其結束試驗��,盡管莫藥已經對輕度新冠患者患者有效�����。需要治療的人數 (NNT) 是一種常用比較藥物危害和益處的定量分析工具�����。作為一般經驗法則�,用于治療癥狀的 NNT為5或以下通常被認為是可以接受的�����,在某些情況下甚至數字低于 10也可以勉強接受���。然而莫藥比較安慰劑的NNT為 15�,即需要治療15位患者才可以讓一位患者或益�����。按照目前的結果,莫藥比不過中和抗體的益處(NNT 為 7.6)��。莫藥成功的原因之一是其非常不同的干擾病毒復制的作用機制:病毒編碼災難�����。莫藥是在體內代謝時��,會變成核糖核苷類似物�����。它假裝是病毒與它們的RNA聚合酶一起使病毒酵素“誤認”���,導致病毒RNA在復制期間出錯�。大量的病毒突變意味著病毒無法自行組裝, 導致“致死突變”(Lethal mutagenesis)讓病毒復制失敗并變異直至死亡,從而抑制病毒的增長��。目前可以殺死病毒的抗病毒藥物很少�����,莫藥首次展示了對抑制呼吸道病毒有效的抑制作用, 可以阻止新冠肺炎的進展���,是一項了不起的進步�����。可以口服是莫藥最大的優(yōu)勢��。輕癥患者不必為了注射而經常跑去醫(yī)院�,方便治療、易普及, 且可供應量更大����。相比單株抗體治療,莫藥的成本更低����,莫藥為期5天的療程花費約為700美元�����,是單株抗體治療的三分之一���。默沙東已為其口服藥申請FDA緊急授權�����。由于莫藥本身機制理論為致死突變����,在宿主DNA復制過程中,莫藥的暴露可能會導致宿主DNA突變���。然而默沙東在臨床實驗時特別設限�,要求實驗者在實驗期間不能進行性行為或采用避孕措施��,無法完全排除莫藥導致畸胎����、先天缺陷或致癌的可能。因此���,潛在的脫靶效應需要進一步調查�����。默沙東表示���,公司已對動物進行測試,沒有發(fā)現(xiàn)基因變異�����。但莫藥是否會對哺乳類動物細胞造成突變的影響,引起腫瘤或畸胎���,還有待觀察�。
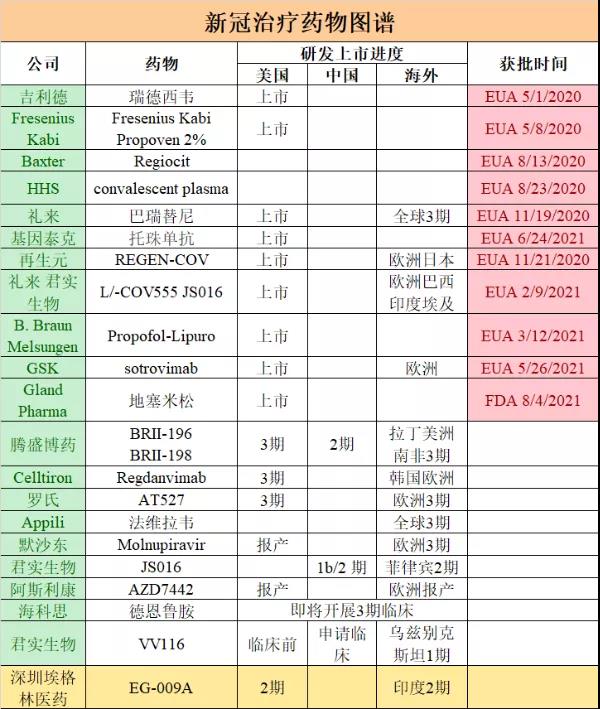
表格1.新冠治療藥物圖譜
近期��,國家有關部委召開“關于新冠肺炎治療藥物研發(fā)進展情況座談會”�����,從全國遴選8家企業(yè)參與���。埃格林醫(yī)藥有幸受邀����,董事長杜濤博士作為代表出席��。我們雖然是一個成立僅兩年的新興生物藥企����,但在新冠治療領域的突飛猛進受到了多方的關注��。中國、美國以及歐洲已經進入“后疫苗時代”���,接種疫苗的人群超過65%-70%這個群體免疫的指標����。但這并不等于今后沒有感染病例�����。一方面�,多方數據顯示,新冠病毒不斷變異, 疫苗的作用在遞減�����;另一方面����,接種疫苗后的突破性感染情況也受到越來越多關注。美國藥企輝瑞(Pfizer)研究發(fā)現(xiàn)�����,完成接種旗下新型冠狀病毒肺炎(COVID-19)疫苗后半年���,疫苗保護力將由88%降至47%����,但預防住院及死亡率仍高達90%。以色列使用輝瑞的mRNA疫苗���,其有效率非常高���,達到95%以上。但在疫苗注射率超過80%后�����,發(fā)生40%的突破性感染��,其中有20%需要住院治療���,10%要進ICU進行強化治療����。美國洛杉磯一項近4萬人的調查數據顯示���,突破性感染達到25%,住院率在1%-5%之間。在醫(yī)療資源的消耗方面�����,美國的ICU床位數每10萬人是35張����,中國大概是每10萬人有3張。從費用來看���,美國進入ICU的病人費用是32萬美元�,普通住院治療是7.5萬美元��。中國如果按照上述數據計算突破性感染的話��,將是一個非常龐大的數據。一旦發(fā)生大的突破性感染����,中國的治療壓力可見一斑���。因此����,新冠治療藥物對于患者的救治乃至整個社會的穩(wěn)定, 都有極其重要的意義, 中國政府高度重視,納入國家戰(zhàn)略予以關注��。
從治療角度來看,目前包括美國EUA在內的批準藥物里��,沒有一個治療新冠肺炎所導致的肺部炎癥��,而埃格林醫(yī)藥開發(fā)的產品就包括這個適應癥�����。全球開發(fā)的治療技術路徑中��,埃格林走的是抗炎這條代表性的路線�,并且采取的是全新的抗炎機制。在開發(fā)策略領域中�,我們選擇在“高監(jiān)管” 環(huán)境下進行開發(fā),簡單理解就是對標美國�、歐洲、日本等較高的藥監(jiān)標準�����。我們認為,只有在嚴格的監(jiān)管標準下開發(fā)的抗新冠肺炎藥物才有可能在未來的患者普及率上有杰出表現(xiàn)����。
EG-009A將用于治療由新冠病毒感染引起的細胞因子風暴。它是一個具有全新機理的抗炎藥�,主要用于治療中重度新冠肺炎,以降低患者的死亡率���。EG-009A是一種選擇性糖皮質激素受體調節(jié)劑����。通過多重篩選1040種天然產物和FDA批準的藥物����,確定了EG-009A選擇性調節(jié)具有臨床意義的GR靶點基因,包括ENaC(上皮鈉離子通道對上皮細胞液平衡起到重要作用)��、FKBP5(與GR敏感性降低和抗性增加有關)和GILZ(抗炎或腫瘤發(fā)生)���。這使得EG-009A具備很好抗炎作用的同時�,可以避免繼發(fā)性感染�����、股骨頭壞死等副作用,且可用于長期治療��。人類的抗體是對抗病毒的關鍵�����,但有時它們會“失控”�����,進而攻擊自身的器官和組織���。新冠病毒感染中期階段����,病毒大致上已停止復制�,中重度患者出現(xiàn)過度活躍的免疫反應,,可能出現(xiàn)危害病人自身的“細胞因子風暴”(CRS)�。EG-009A可以通過反式抑制,其中活化的單體GR與其他轉錄因子(如 NF-κB 和 AP-1)結合����,防止其促炎基因的表達, 從而通過多靶點抑制過度的免疫反應, 抑制細胞因子風暴�����,如降低腫瘤壞死因子���、IL-6����、IL-1β和G-CSF等等因子來治療中重度新冠肺炎。EG-009A的治療方向為中重度新冠肺炎疾病���。顧名思義����,新冠病毒對肺部的感染非常明顯��,達到50%-80%��。然而�����,F(xiàn)DA批準的10個EUA中,還未涉及到解決肺炎治療的問題�����。埃格林醫(yī)藥EG-009A的切入點即在此�����。我們此前和FDA開了兩次溝通會��,最后達成了EG-009A治療終點的5項肺衰竭相關硬核指標��,分別是:是否上呼吸機���、是否使用高流量給氧�����、是否使用無創(chuàng)性的正壓通氣機�、是否用體外膜肺氧合機(ECMO)以及是否出現(xiàn)其他典型的臨床肺衰竭癥狀��。EG-009A有口服和肌肉注射兩個劑型�����, 各有特色。兩種劑型可以分別用��,也可以聯(lián)合使用����。如先給起效快的注射劑,快速提高血液藥濃度�����,然后用口服劑來保持血藥濃度����,方便患者使用�����。在高監(jiān)管環(huán)境下加速開發(fā)埃格林醫(yī)藥之所以選擇立足“高監(jiān)管”市場的策略���,主要有如下考量����。作為預防性疫苗�,WHO的準入會區(qū)分“高監(jiān)管”與“低監(jiān)管”國家的審核周期。如輝瑞在美國獲批的疫苗,WHO用時一周時間批準����。對于中國的疫苗,國藥�、科興都花費了五六個月才拿到WHO認定。這首先是一個速度快慢的問題�。更加重要的是,WHO目前在治療藥品上沒有一個成熟的互認機制��,它對治療藥物的批準缺乏足夠的影響力���,后者實際上仍落后于很多國家的藥監(jiān)部門���。而在國家與國家之間,治療藥物的互認是相對可行的��,尤其是“高監(jiān)管”地區(qū)批準的產品����。就以香港來舉例,如果一個藥品在美國和歐洲兩地獲批����,其在香港的注冊申報會非常簡單�,大約幾周時間即可上市���。除此之外����,埃格林團隊擁有五位FDA的前審評官員��,在法規(guī)方面知識的積累支撐著我們走“高監(jiān)管”路線�����,不是尋求WHO的準入���,而是尋求FDA或EUA的批準。通過“高監(jiān)管”的優(yōu)勢�,我們可以避免產生一些不確定因素,加速走向全球�。總的來講,我們新冠治療藥物的開發(fā)方向與國家戰(zhàn)略相呼應�,思路沿著臨床價值鏈走,在“組合拳”道理中實施研發(fā)與推進���,希望能在未被滿足的治療領域有所突破�,為全球的新冠疫情防治做出貢獻。