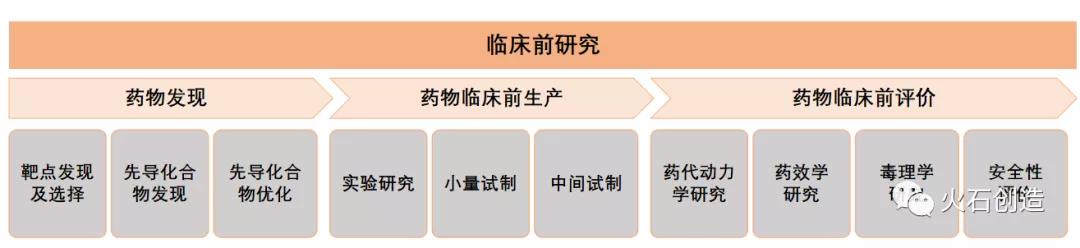
藥物臨床前研究,一個對于普羅大眾仍顯陌生的名詞��,隨著醫(yī)藥研發(fā)外包服務(wù)(CRO)的發(fā)展越來越頻繁地出現(xiàn)在公眾視野��。乘著國產(chǎn)創(chuàng)新藥崛起的東風(fēng)�����,臨床前研究在國內(nèi)受到前所未有的重視�����。概況:創(chuàng)新戰(zhàn)略驅(qū)動高速增長藥物臨床前研究是指藥物在進(jìn)入臨床研究階段之前的相關(guān)研究工作�,一般包括藥物發(fā)現(xiàn)����、藥物臨床前生產(chǎn)和藥物臨床前評價3個方面。其中藥物發(fā)現(xiàn)包括藥物靶點發(fā)現(xiàn)及選擇�、先導(dǎo)化合物發(fā)現(xiàn)和先導(dǎo)化合物優(yōu)化;藥物臨床前生產(chǎn)主要是化學(xué)藥和生物藥的實驗研究�、小量試劑和中間試劑;藥物臨床前評價則包括藥物動力學(xué)研究�����、藥效學(xué)研究、毒理學(xué)研究和安全性評價等����。
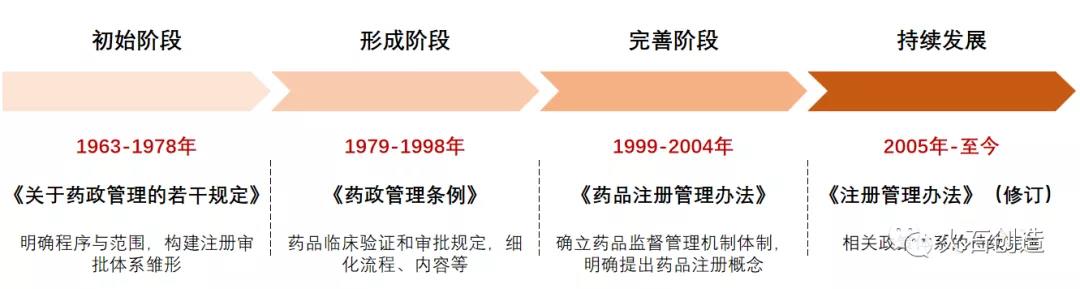
來源:火石創(chuàng)造根據(jù)公開資料整理我國的藥物研究發(fā)源于20世紀(jì)60年代。1963年衛(wèi)生部����、化工部和商務(wù)部聯(lián)合下發(fā)《關(guān)于藥政管理的若干規(guī)定》,明確了藥品的定義�,審批注冊程序,臨床研究��,生產(chǎn)審批和審批藥品的范圍���,提出了藥物在生產(chǎn)前需要經(jīng)過相關(guān)試驗研究�����,形成了最早的注冊審批體系雛形����。1979年《新藥管理辦法》和1985年《新藥審批辦法》《新生物制品審批辦法》以及后續(xù)的一系列補(bǔ)充規(guī)定��,明確了各類新藥在申請臨床試驗和申報生產(chǎn)時需提供安全性����、有效性��、質(zhì)量��、穩(wěn)定性�����、臨床試驗等技術(shù)資料����,藥品注冊政策體系初步形成�。1999年國家藥監(jiān)局成立��,進(jìn)一步確立藥品注冊審批監(jiān)督管理體制���,2002年《藥品注冊管理辦法》發(fā)布����,此后在2005年���、2007年和2020年分別修訂�����,藥品注冊政策進(jìn)入持續(xù)完善階段��。
來源:火石創(chuàng)造根據(jù)公開資料整理為提高創(chuàng)新效率��,藥物臨床前研究作為藥品研發(fā)的重要環(huán)節(jié)���,20世紀(jì)80年代初在美國已出現(xiàn)研發(fā)外包模式����,CRO產(chǎn)業(yè)最初聚焦于臨床前和臨床藥物的研發(fā)����,在隨后數(shù)10年的發(fā)展中,經(jīng)歷了擴(kuò)張�、合并和重組這3個階段,并成為了真正意義上的全球性產(chǎn)業(yè)����。2001年,藥明康德集團(tuán)成立上海藥明����,進(jìn)入臨床前CRO領(lǐng)域����,拉開了中國本土CRO發(fā)展序幕����。2003年國家食藥監(jiān)局通過《藥物臨床試驗質(zhì)量管理規(guī)范》,臨床試驗申辦者可委托合同研究組織執(zhí)行臨床試驗中的某些工作和任務(wù)�����,在法規(guī)上肯定了CRO公司在新藥研發(fā)中的作用和地位��。發(fā)展至今��,臨床前CRO已成為藥品研發(fā)中的關(guān)鍵組成部分���,以及我國生物制藥創(chuàng)新遠(yuǎn)景的必要組成�����,維持著生物醫(yī)藥創(chuàng)新生態(tài)系統(tǒng)的活力。此前我國藥品研發(fā)企業(yè)以仿制藥為主����,藥品安全性和有效性已得到驗證����,在藥品藥理���、毒理研究階段的業(yè)務(wù)需求較小�,臨床前CRO市場規(guī)模相對有限��。國家頂層設(shè)計要求新藥創(chuàng)新��、逐步與國際同軌之后�����,推動醫(yī)藥產(chǎn)業(yè)從仿制為主轉(zhuǎn)向自主創(chuàng)新��,促進(jìn)了制藥企業(yè)在創(chuàng)新藥研發(fā)方面的投入��,直接帶動臨床前CRO的增長�����。2014年我國臨床前CRO市場規(guī)模約7億美元����,到2020年達(dá)到21億美元���,年均復(fù)合增長率約20%。我國臨床前CRO目前尚處于初級發(fā)展階段���,預(yù)計未來幾年仍將保持20%的高速增長�����,至2024年成長至41億美元規(guī)模��。
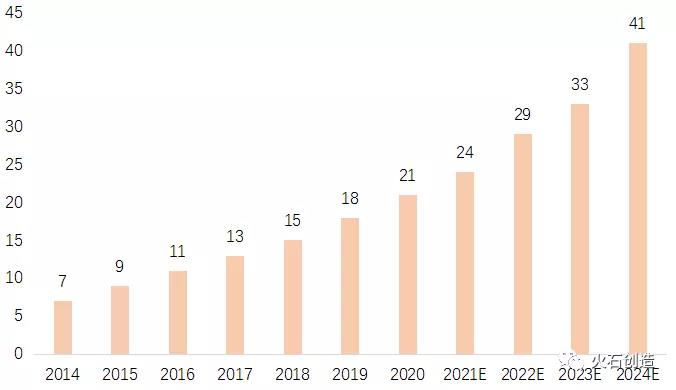
圖 3 :我國臨床前CRO市場規(guī)模(億美元)來源:火石創(chuàng)造根據(jù)Frost & Sullivan及公開資料整理近年來支持新藥研發(fā)��、醫(yī)保改革�、鼓勵醫(yī)藥外包服務(wù)等一系列政策陸續(xù)出臺�,極大促進(jìn)了臨床前研究的規(guī)模壯大,第三方專業(yè)化服務(wù)趨勢明顯����。一是通過加速新藥審評刺激企業(yè)研發(fā)和生產(chǎn)積極性。2015年《關(guān)于改革藥品醫(yī)療器械審評審批制度的意見》出臺�,拉開了以“解決注冊申請積壓”為目標(biāo)和“改進(jìn)藥品臨床試驗審批”“鼓勵研究和創(chuàng)制新藥”為主要任務(wù)的改革序幕。后續(xù)《關(guān)于解決藥品注冊申請實行有限審評審批的意見》《關(guān)于鼓勵藥品創(chuàng)新實行優(yōu)先審評審批的意見》《關(guān)于調(diào)整藥物臨床試驗審評審批程序的公告》等系列政策的出臺直接推動新藥研發(fā)�。疊加藥品上市許可持有人制度等政策落地,新藥審評審評明顯提速���,激發(fā)了優(yōu)質(zhì)醫(yī)藥研發(fā)服務(wù)企業(yè)的研發(fā)與生產(chǎn)積極性��。二是調(diào)整醫(yī)保支付結(jié)構(gòu)強(qiáng)化創(chuàng)新藥和器械的競爭優(yōu)勢���。醫(yī)保政策從整體控費轉(zhuǎn)向支持創(chuàng)新。2019年醫(yī)保局發(fā)布《國家基本醫(yī)療保險��、工傷保險和生育保險藥品目錄》并建立動態(tài)調(diào)整機(jī)制����,通過加快調(diào)整頻率縮短創(chuàng)新藥進(jìn)入醫(yī)保時間。2020年底《關(guān)于推動藥品集中帶量采購工作常態(tài)化制度化開展的意見》建立常態(tài)化集采機(jī)制����,意味著仿制藥利潤被大幅壓縮,倒逼企業(yè)轉(zhuǎn)向新藥研發(fā)�����。三是政策引導(dǎo)和支持醫(yī)藥研發(fā)外包����。作為支持創(chuàng)新藥發(fā)展的配套手段�,幫助企業(yè)降低前期研發(fā)成本�,未來的政策導(dǎo)向是通過支持第三方服務(wù)推動臨床前研究和臨床試驗進(jìn)一步專業(yè)化。早在2009年《國務(wù)院辦公廳關(guān)于印發(fā)促進(jìn)生物產(chǎn)業(yè)加快發(fā)展若干政策的通知》就提出推進(jìn)生物醫(yī)藥研發(fā)外包��,2018年國家發(fā)改委����、工信部、衛(wèi)健委�����、藥監(jiān)局發(fā)布《關(guān)于組織實施生物醫(yī)藥合同研發(fā)和生產(chǎn)服務(wù)平臺建設(shè)專項的通知》����,開展實施生物醫(yī)藥合同研發(fā)和生產(chǎn)服務(wù)平臺建設(shè)專項,對符合條件的生物醫(yī)藥CRO和醫(yī)藥制造外包服務(wù)(CMO)進(jìn)行國家補(bǔ)助計劃����。與此同時,為打造本地醫(yī)藥產(chǎn)業(yè)集聚發(fā)展態(tài)勢���,各省市也紛紛出臺相關(guān)鼓勵和引導(dǎo)性政策�����,大力鼓勵支持本地區(qū)第三方研發(fā)及代工生產(chǎn)服務(wù)發(fā)展��。競爭:加速整合強(qiáng)化龍頭優(yōu)勢臨床前CRO的發(fā)展呈現(xiàn)兩級分化的格局��。在新藥研發(fā)方面��,頭部企業(yè)寡頭化競爭��,例如專注于安全性評價的昭衍新藥�����、專注于藥物發(fā)現(xiàn)的康龍化成����、專注于藥效評價的中美冠科等���,而大多數(shù)臨床前CRO企業(yè)規(guī)模小�����、服務(wù)能力差�。根據(jù)統(tǒng)計�,我國醫(yī)藥研發(fā)外包企業(yè)上千家����,營收500萬元以下的企業(yè)占65%��,這些企業(yè)主要承接一些技術(shù)需求較低��、門檻不高的服務(wù)內(nèi)容�����,同質(zhì)化競爭激烈���。在行業(yè)快速增長且競爭加劇的背景下���,企業(yè)兼并加速、行業(yè)集中度提高是必然趨勢�����。
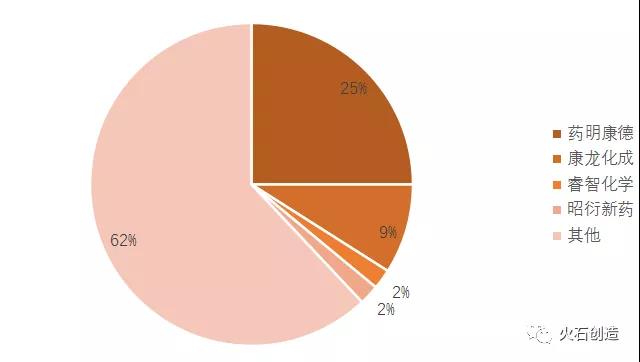
圖 4:2020年國內(nèi)臨床前CRO市場占有率來源:火石創(chuàng)造根據(jù)公開資料整理在地域分布上�����,臨床前CRO企業(yè)主要分布在北京����、上海�����、江蘇等沿海發(fā)達(dá)地區(qū)�����,共同特征是產(chǎn)業(yè)園區(qū)發(fā)展相對成熟、醫(yī)藥企業(yè)相對集中�����、創(chuàng)新創(chuàng)業(yè)產(chǎn)業(yè)發(fā)展活躍�����、人才以及教育資源較為豐富等�。截至2020年底,北京市CRO企業(yè)數(shù)量位于全國榜首�����,共268家�����,其中134家臨床前CRO企業(yè)和44家綜合CRO企業(yè);上海市共有187家CRO企業(yè)���,其中97家臨床前CRO企業(yè)和23家綜合CRO企業(yè)��;江蘇省CRO企業(yè)數(shù)量位于全國第三����,共182家��,其中95家臨床前CRO企業(yè)和28家綜合CRO企業(yè)���,主要分布于蘇州���、南京、泰州3個城市��。而隨著行業(yè)兼并提速和各地區(qū)生物醫(yī)藥研發(fā)投入的增加���,未來臨床前CRO龍頭企業(yè)將加速在內(nèi)陸重點城市的布局����。
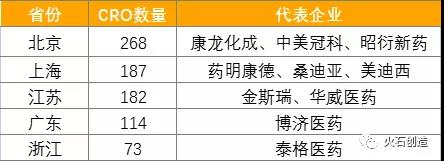
圖 5 :國內(nèi)CRO企業(yè)地域分布(家)來源:火石創(chuàng)造根據(jù)公開資料整理國內(nèi)新藥研發(fā)支出不斷擴(kuò)大��,增長速度遠(yuǎn)高于全球水平��。2014年我國醫(yī)藥研發(fā)投入約93億美元�����,2020年增長至285億美元�����,年復(fù)合增長率約20%�,未來預(yù)計仍將保持年均20%以上的高速增長�����。
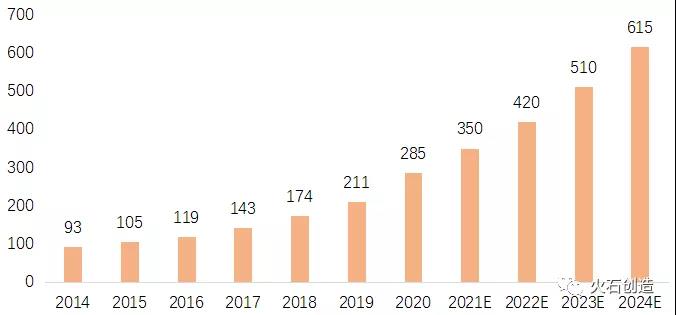
圖 6 :中國醫(yī)藥研發(fā)投入(億美元)來源:火石創(chuàng)造根據(jù)Frost & Sullivan及公開資料整理得益于相關(guān)政策對醫(yī)藥創(chuàng)新的持續(xù)支持�,總體來看臨床前研究呈現(xiàn)以下3大發(fā)展趨勢:一是臨床前CRO機(jī)構(gòu)由發(fā)達(dá)國家向發(fā)展中國家轉(zhuǎn)移。由于專利藥到期���、新藥研發(fā)速度變慢以及專利政策的調(diào)整�,跨國制藥企業(yè)面臨著收入增長放緩的壓力���。為提高新藥投放效率����,跨國制藥企業(yè)開始在全球范圍整合研發(fā)體系,將部分研發(fā)工作轉(zhuǎn)移到新興市場國家�。以中國為代表的發(fā)展中國家具備成本優(yōu)勢、人才供給優(yōu)勢��,以及國內(nèi)新藥研發(fā)催生的大量需求��,推動CRO行業(yè)快速發(fā)展�,全球外包服務(wù)市場陸續(xù)開始從西方成熟市場向亞洲等新興市場轉(zhuǎn)移。二是CRO行業(yè)內(nèi)融合提速����,發(fā)展呈縱向一體化。從醫(yī)藥研發(fā)環(huán)節(jié)上看����,新藥研發(fā)是一個系統(tǒng)化工程,行業(yè)內(nèi)的參與者不僅要在各自專精的階段提供高質(zhì)量的研發(fā)生產(chǎn)服務(wù)�����,還需要圍繞客戶需求不斷拓展產(chǎn)業(yè)鏈上下游領(lǐng)域,通過高標(biāo)準(zhǔn)���、全產(chǎn)業(yè)鏈��、與客戶形成長期合作關(guān)系等構(gòu)筑競爭壁壘�。近年來����,CRO產(chǎn)業(yè)上下游融合、CRO向醫(yī)藥外包綜合服務(wù)(CDMO)融合�����,CDMO向CRO融合����,CRO向醫(yī)藥營銷外包(CSO)融合��,CRO向相關(guān)產(chǎn)業(yè)融合�,提供從前端研發(fā)到后端生產(chǎn)到相關(guān)產(chǎn)業(yè)的一站式服務(wù),縱向一體化發(fā)展成為外包服務(wù)龍頭的重要戰(zhàn)略布局����。三是CRO與藥企間的戰(zhàn)略合作持續(xù)深化。隨著CRO專業(yè)服務(wù)能力的提升,企業(yè)合作模式也發(fā)生變化���。從傳統(tǒng)的合同交付模式�,到進(jìn)階的部分執(zhí)行模式���,再到戰(zhàn)略層面的共同研發(fā)模式�,CRO與企業(yè)間的捆綁程度逐漸加深�����。在戰(zhàn)略合作模式下����,CRO與企業(yè)共同投資研發(fā)項目,共同承擔(dān)研發(fā)風(fēng)險�����,在把控風(fēng)險的情況下大大提高CRO收入����。CRO集中度提升、行業(yè)龍頭服務(wù)能力加強(qiáng)����、新藥研發(fā)成本和風(fēng)險越來越高等發(fā)展環(huán)境推動越來越多的CRO與大型跨國藥企建立風(fēng)險共擔(dān)��、利益共享的合作研發(fā)模式����。結(jié)語:專業(yè)服務(wù)加速產(chǎn)業(yè)創(chuàng)新在鼓勵創(chuàng)新與接軌國際的大背景下�,創(chuàng)新藥發(fā)展是大勢所趨,藥物臨床前研究的重要性愈發(fā)凸顯���。而隨著新藥研發(fā)成本持續(xù)提升���,研發(fā)難度持續(xù)加大,成功率不斷降低����,生物醫(yī)藥企業(yè)與臨床前CRO合作的必要性也逐步提升。對于生物醫(yī)藥企業(yè)而言����,應(yīng)結(jié)合自身戰(zhàn)略定位���,合理規(guī)劃研發(fā)投入�,加強(qiáng)與CRO的戰(zhàn)略合作以實現(xiàn)降本增效,加速藥械研發(fā)進(jìn)程���。而對于正在謀劃生物醫(yī)藥產(chǎn)業(yè)的地區(qū)��,政府和園區(qū)機(jī)構(gòu)需要重視第三方專業(yè)服務(wù)平臺的構(gòu)建��,在產(chǎn)業(yè)集聚初期合理布局相應(yīng)臨床前CRO機(jī)構(gòu)���,并配套相應(yīng)的支持政策,有助于降低中小企業(yè)研發(fā)成本��,加快本地生物醫(yī)藥產(chǎn)業(yè)培育速度�����。











