8月17日�,中國國家藥監(jiān)局藥品審評中心(CDE)最新公示��,由復(fù)星凱特申報(bào)的阿基侖賽注射液被納入突破性治療藥物程序��,擬用于治療接受過二線或以上系統(tǒng)治療后復(fù)發(fā)或難治性惰性非霍奇金淋巴瘤����。這是繼今年6月阿基侖賽在中國獲批上市之后,該產(chǎn)品近期迎來的又一重要進(jìn)展���。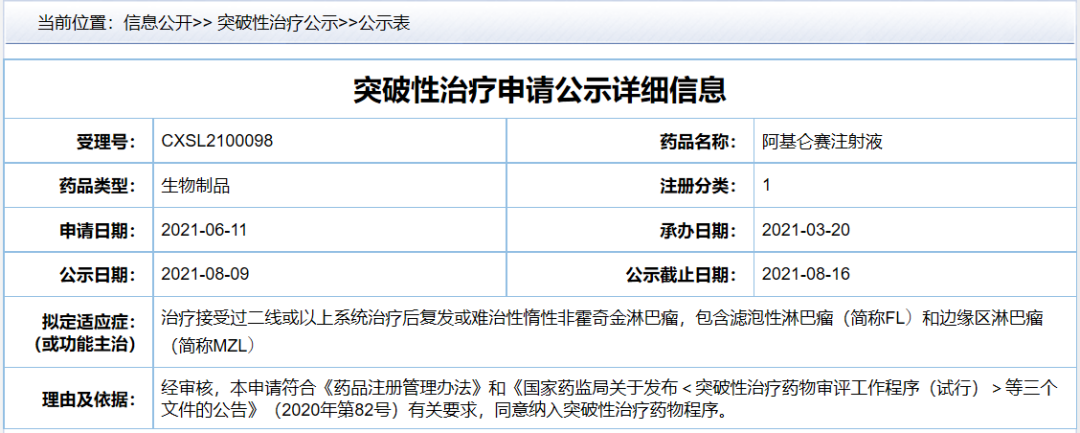
阿基侖賽注射液(代號:FKC876)是復(fù)星凱特于2017年從吉利德科學(xué)(Gilead Sciences)旗下公司Kite引進(jìn)Yescarta(Axicabtagene Ciloleucel)��、進(jìn)行技術(shù)轉(zhuǎn)移����、并獲授權(quán)在中國進(jìn)行本地化生產(chǎn)的靶向CD19自體CAR-T細(xì)胞治療產(chǎn)品��。CAR-T免疫細(xì)胞治療是通過基因工程修飾患者自體T細(xì)胞��,以表達(dá)靶向腫瘤抗原的嵌合抗原受體分子���,由激活的T細(xì)胞介導(dǎo)殺傷腫瘤細(xì)胞����。6月22日�,復(fù)星凱特宣布阿基侖賽注射液(商品名:奕凱達(dá))已正式在中國獲批上市,用于治療既往接受二線或以上系統(tǒng)性治療后復(fù)發(fā)或難治性大B細(xì)胞淋巴瘤(r/r LBCL)成人患者��。這是首個(gè)且目前唯一獲中國國家藥監(jiān)局批準(zhǔn)的CAR-T產(chǎn)品��,這一批準(zhǔn)也意味著中國正式邁入CAR-T細(xì)胞治療的新時(shí)代���。

此次阿基侖賽注射液在中國被納入突破性治療藥物程序���,擬用于治療復(fù)發(fā)或難治性惰性非霍奇金淋巴瘤,且接受過二線或以上系統(tǒng)治療的患者����,包含濾泡性淋巴瘤(FL)和邊緣區(qū)淋巴瘤(MZL)患者。FL和MZL均為惰性NHL�,患者的惡性腫瘤生長緩慢,但隨時(shí)間推移可變得更具侵襲性��。其中�,F(xiàn)L是最常見的惰性淋巴瘤,它約占全世界確診的淋巴瘤的22%��。MZL是第三常見的淋巴瘤,占所有B細(xì)胞NHL的8%-12%��。在美國��,Yescarta也曾被FDA授予這些適應(yīng)癥的突破性療法認(rèn)定���。Kite公司于2020年9月向FDA提交了Yescarta的補(bǔ)充生物制品許可申請(sBLA)���,并于2021年3月獲得FDA加速批準(zhǔn),用于治療既往接受過兩線以上系統(tǒng)性治療的復(fù)發(fā)/難治性濾泡性淋巴瘤患者����。這一批準(zhǔn),使得Yescarta成為第一款獲批用于治療惰性濾泡性淋巴瘤患者的CAR-T產(chǎn)品��。Kite公司本次sBLA的提交基于Yescarta的2期臨床試驗(yàn)ZUMA-5的主要分析結(jié)果�。根據(jù)2020年12月份美國臨床血液學(xué)會(ASH)年會上公布的ZUMA-5分析結(jié)果,在中位隨訪時(shí)間達(dá)到17.5個(gè)月時(shí)���,療效可評估的104例惰性非霍奇金淋巴瘤患者的總緩解率(ORR)達(dá)到92%�,完全緩解率(CR)達(dá)到76%����,其中濾泡淋巴瘤患者的ORR為94%��,CR達(dá)到80%���,中位DOR尚未達(dá)到,64%的患者在數(shù)據(jù)截止時(shí)仍保持緩解��。ZUMA-5中未發(fā)現(xiàn)新的與Axi-Cel相關(guān)的不良事件���。Kite公司曾在新聞稿中表示,惰性NHL患者的疾病開始時(shí)進(jìn)展緩慢��,但隨著時(shí)間的推移��,每次復(fù)發(fā)變得更具侵襲性����。在ZUMA-5中觀察到的療效可能為某些類型的惰性NHL高危患者提供一種潛在的變革性治療選擇�。希望復(fù)星凱特的阿基侖賽注射液早日在中國獲批新適應(yīng)癥,為更多惰性非霍奇金淋巴瘤帶來新的治療選擇��。



