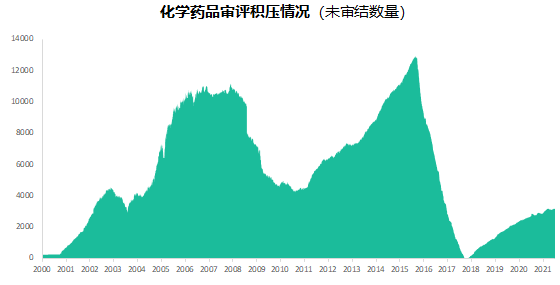
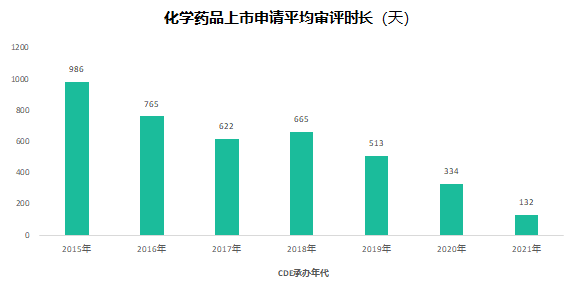
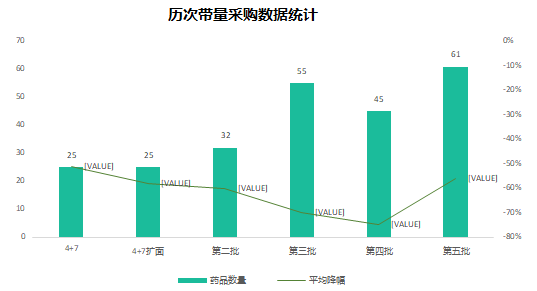
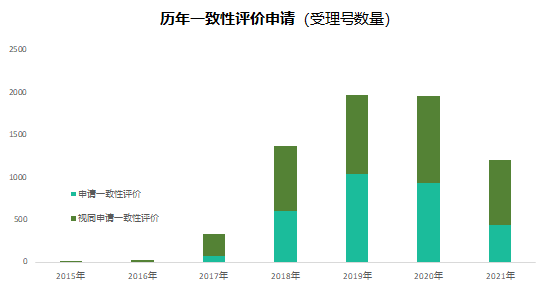
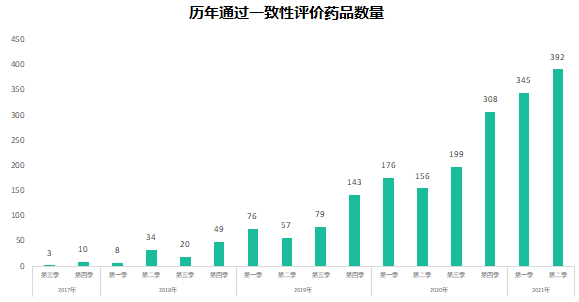
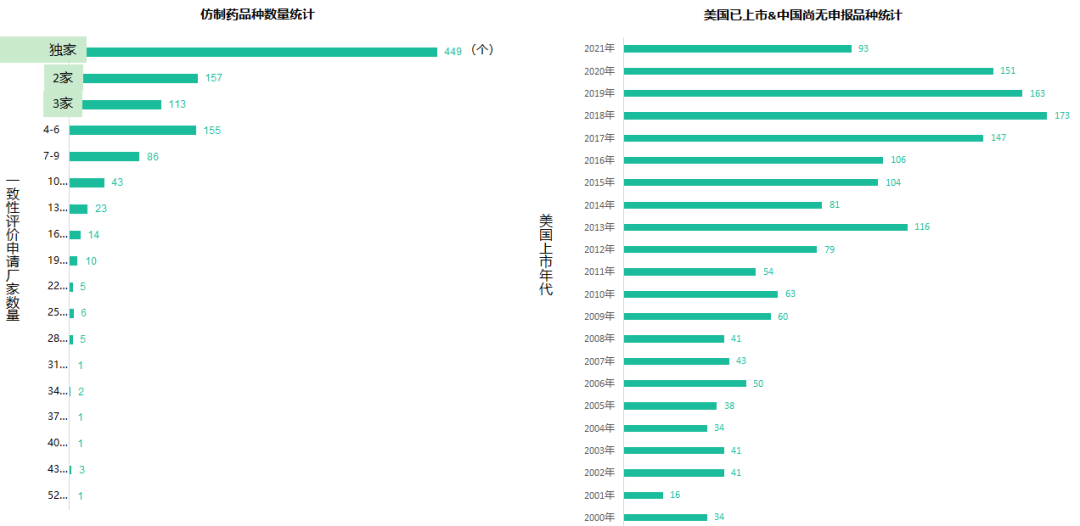
六年前的7月22日�,國家食品藥品監(jiān)督管理總局發(fā)布《關于開展藥物臨床試驗數(shù)據自查核查工作的公告》(2015年第117號),正式拉開藥品監(jiān)管制度深化改革的序幕。隨后�����,《關于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》發(fā)布��,明確了藥品醫(yī)療器械審評審批改革的目標���、任務和具體措施��,也宣告解決藥品審評積壓����、提高藥品審批質量和仿制藥水平的工作強力開啟�。6年時光,轉瞬即逝�����,有歡樂、有痛苦��、有迷茫也有堅定��;6年間��,中國的仿制藥開發(fā)都有哪些變化����,不妨隨我們一起回顧。審評審批制度改革意見共提出了5大目標和12項措施�,其中��,提高審評審批質量和解決注冊申請積壓正是5大目標之一,目的是要建立科學�����、高效的審評審批體系和按規(guī)定時限完成藥品審批。醫(yī)藥魔方PharmaGo數(shù)據顯示���,CDE在2017年底就解決了申請積壓的問題���。此后,CDE又逐步實施增加審評隊伍、提高審評質量、提高仿制藥質量標準、推進一致性評價等舉措,從人力和制度上進一步解決造成審批積壓的原因���。與此同時����,可以看到CDE的審評審批速度實現(xiàn)了大幅提升����。對于新申報的化學藥品上市申請,已經由2015年的986天提高至2020年的334天���。2020年7月新版《藥品注冊管理辦法》開始執(zhí)行�,明確要求化學藥品上市申請審批期限為200日�����,這一目標已經在2021年申報的藥品審評中有所體現(xiàn)���。2018年底�����,國家藥品監(jiān)督管理局發(fā)布的《關于仿制藥質量和療效一致性評價有關事項的公告》指出����,對通過仿制藥質量和療效一致性評價的品種優(yōu)先納入目錄,未通過一致性評價的品種將逐步被調出目錄�����,并充分考慮基本藥物保障臨床需求的重要性��,對納入國家基本藥物目錄的品種,不再統(tǒng)一設置基本藥物評價時限要求��。此舉說明國家藥品監(jiān)督管理局不再統(tǒng)一要求在2018年底前完成基本藥物的一致性評價�。不過,仿制藥一致性評價已經成為企業(yè)的常態(tài)化行為��,尤其在國家執(zhí)行的帶量采購中���,未通過仿制藥一致性評價就沒有申報資格�����。同時�����,帶量采購也趨于合理化���,不會刻意壓縮企業(yè)的合理利潤。在剛結束的第五批帶量采購中��,不僅藥品中標數(shù)量歷年最多�,藥品價格也首次出現(xiàn)相對上漲。龐大的市場銷量�,成為推動企業(yè)加速完成仿制藥一致性評價的動力。根據PharmaGo的數(shù)據����,2019年成為仿制藥申請一致性評價的頂峰。隨著2020年7月新版《藥品注冊管理辦法》正式執(zhí)行�,按新注冊分類申報的仿制藥視同通過一致性評價,存量仿制藥申請一致性評價的數(shù)量逐漸走低����。與之相對應�����,獲批通過仿制藥一致性評價的產品數(shù)量也在不斷增加����。預示著���,企業(yè)正在加速完成仿制藥的一致性評價工作���。隨著企業(yè)完成自己的戰(zhàn)略品種的一致性評價,存量仿制藥的一致性評價也必將被新注冊分類申報所替代����。以上是基于藥品注冊歷史數(shù)據對過去6年我國仿制藥開發(fā)變化的一個概覽,以及對未來仿制藥注冊申報趨勢的一個推演�。如果從品種競爭的角度去看,中國仿制藥開發(fā)一直存在兩種極端現(xiàn)象�,一方面是同質化競爭,重復嚴重�����。即便總局發(fā)布多批過度重復藥品目錄對行業(yè)進行引導和警示����,藥企扎堆申報熱門品種的現(xiàn)象仍然存在�。尤其他達拉非�����,2005年至今一直是企業(yè)熱衷的藥物品種��;此外����,阿哌沙班�、利伐沙班等藥物的申報熱度也始終未見衰退。另一方面��,與過度重復申報截然相反���,中國仿制藥的獨家品種仍然占據過高的比例����,目前有449個品種僅一家企業(yè)申報一致性評價�;同時,眾多在美國已經獲批上市的藥物�,國內尚無申報記錄��,其中也不乏專利過期品種��。無論是過度重復�,還是一家獨大�,造成這種申報兩極分化的主要原因之一就是信息不對稱。眾所周知�,藥品申報同樣存在黑箱期,在藥品申報公示或BE登記之前����,國內企業(yè)的藥品立項品種和研發(fā)進度����,外界無從獲悉。一旦企業(yè)完成相關申報研究之后�,即使出現(xiàn)多家申報的現(xiàn)象,恐怕更多的企業(yè)也不愿放棄����,尤其耗費了一定的研發(fā)費用之后。因此���,就又出現(xiàn)新的重復申報品種��。總之���,仿制藥的開發(fā)要綜合市場預期�����、企業(yè)戰(zhàn)略規(guī)劃�、生產線���、業(yè)務優(yōu)勢��、外部競爭環(huán)境等因素綜合考慮�。在當下的仿制藥市場競爭環(huán)境下����,特別是國家集中采購已經常態(tài)化之后,市場競爭形勢已經發(fā)生深刻改變���。越早獲悉競品動向,越有可能避免扎堆、減少研發(fā)浪費���,更有助于將資源投入到回報率更高的研發(fā)活動中��。