第3項(xiàng)適應(yīng)癥����!君實(shí)生物抗PD-1抗體新藥獲批治療尿路上皮癌
2021-04-08 14:17:23
根據(jù)中國(guó)國(guó)家藥監(jiān)局(NMPA)最新公示�,由君實(shí)生物研發(fā)的PD-1抑制劑特瑞普利單抗(拓益)新適應(yīng)癥上市申請(qǐng)(sNDA)審評(píng)審批狀態(tài)已更新為:審批完畢-待制證���,批準(zhǔn)文號(hào)為:國(guó)藥準(zhǔn)字S20191003����。這意味著,該新適應(yīng)癥已正式在中國(guó)獲批�。根據(jù)受理號(hào)信息查詢可知,此次獲批適應(yīng)癥為:于既往接受系統(tǒng)治療失敗或不可耐受的局部進(jìn)展或轉(zhuǎn)移性尿路上皮癌�。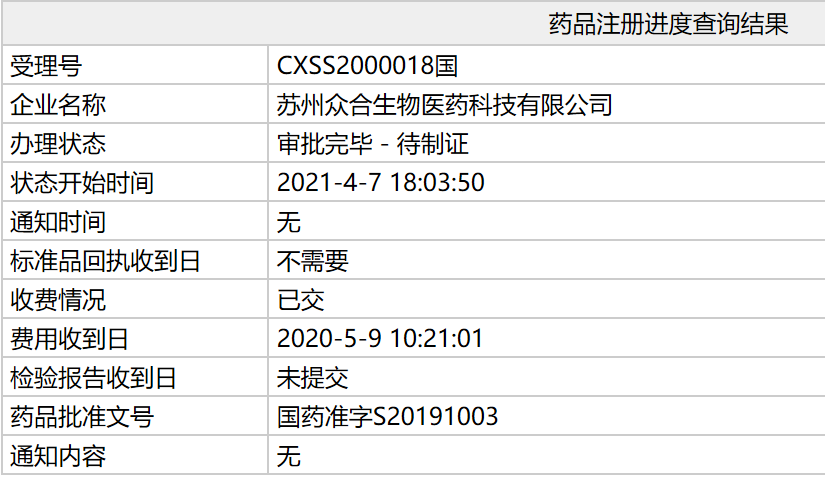
特瑞普利單抗是一款由君實(shí)生物自主研發(fā)的抗PD-1單抗藥物。它于2018年12月首次獲NMPA批準(zhǔn)上市���,用于既往接受全身系統(tǒng)治療失敗的不可切除或轉(zhuǎn)移性黑色素瘤的治療��,由此成為中國(guó)首個(gè)批準(zhǔn)上市的以PD-1為靶點(diǎn)的國(guó)產(chǎn)單抗藥物��。2021年2月��,該藥物獲NMPA批準(zhǔn)用于治療既往接受過(guò)二線及以上系統(tǒng)治療失敗的復(fù)發(fā)/轉(zhuǎn)移性鼻咽癌(NPC)患者���,成為全球首個(gè)獲批鼻咽癌治療的抗PD-1單抗藥物。根據(jù)君實(shí)生物早前發(fā)布的新聞稿����,此次獲批尿路上皮癌的新適應(yīng)癥上市申請(qǐng)�,是基于一項(xiàng)開放性����、單臂、多中心����、2期關(guān)鍵注冊(cè)臨床研究(POLARIS-03),該研究旨在評(píng)估特瑞普利單抗治療標(biāo)準(zhǔn)治療失敗后的局部進(jìn)展或轉(zhuǎn)移性膀胱尿路上皮癌患者的安全性和有效性��,由北京大學(xué)腫瘤醫(yī)院郭軍教授與上海交通大學(xué)醫(yī)學(xué)院附屬仁濟(jì)醫(yī)院黃翼然教授共同牽頭�。根據(jù)在2020年2月的美國(guó)臨床腫瘤學(xué)會(huì)泌尿生殖系統(tǒng)腫瘤研討會(huì)(ASCO GU)上公布的臨床入組結(jié)束后的分析數(shù)據(jù),至數(shù)據(jù)截止日�,獨(dú)立評(píng)估結(jié)果顯示:在符合評(píng)估條件的148例患者中,總體客觀緩解率(ORR)為25.7%�,PD-L1陽(yáng)性患者(46例,31.1%)ORR達(dá)到41.3%�;OS數(shù)據(jù)尚未成熟,安全性數(shù)據(jù)與特瑞普利單抗過(guò)往報(bào)道基本一致��。值得一提的是�,該尿路上皮癌的新適應(yīng)癥上市申請(qǐng),曾于2020年7月被NMPA藥品審評(píng)中心(CDE)納入優(yōu)先審評(píng)����,這對(duì)于該適應(yīng)癥在中國(guó)的獲批速度有所加快。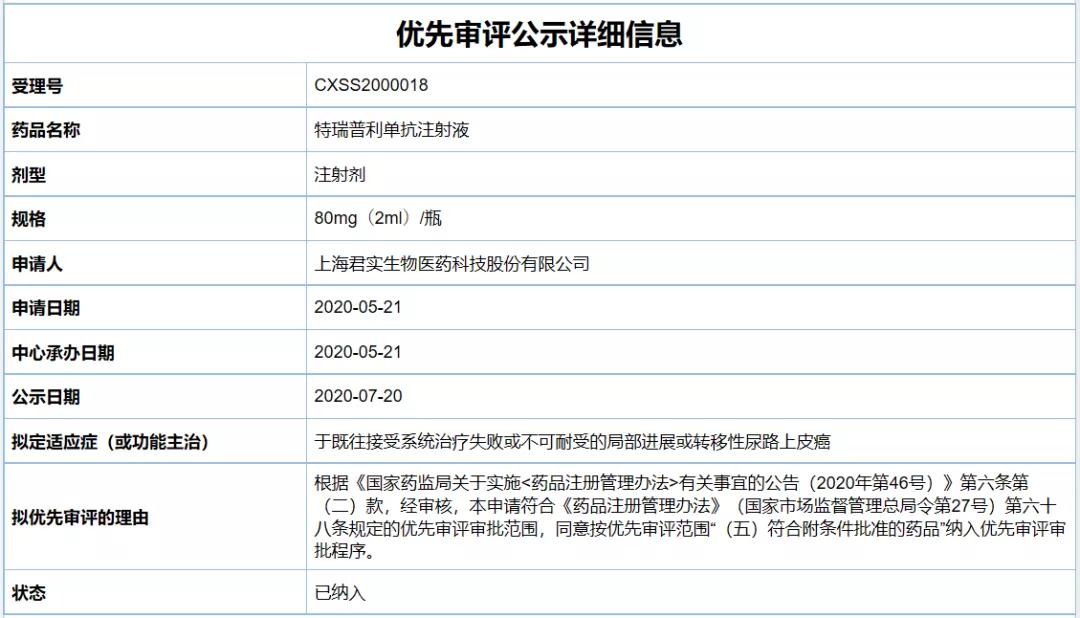
尿路上皮癌是全球范圍內(nèi)最常見的泌尿系統(tǒng)癌癥���。早期以手術(shù)治療為主�,對(duì)于不能手術(shù)的局部進(jìn)展或轉(zhuǎn)移性尿路上皮癌患者��,以鉑類為基礎(chǔ)的化療是其標(biāo)準(zhǔn)的一線治療��,隨著化療敏感性下降���,會(huì)導(dǎo)致腫瘤復(fù)發(fā)和疾病進(jìn)展���。對(duì)于此類標(biāo)準(zhǔn)治療后出現(xiàn)疾病進(jìn)展的晚期尿路上皮癌患者,目前在中國(guó)的治療手段非常有限�。值得一提的是,2021年2月���,君實(shí)生物已與Coherus BioSciences達(dá)成合作��,在美國(guó)和加拿大共同開發(fā)和商業(yè)化特瑞普利單抗��。今年3月���,君實(shí)生物與阿斯利康(AstraZeneca)達(dá)成商業(yè)化合作���,授予后者拓益在中國(guó)大陸地區(qū)后續(xù)獲批上市的泌尿腫瘤領(lǐng)域適應(yīng)癥的獨(dú)家推廣權(quán),以及所有獲批適應(yīng)癥在非核心城市區(qū)域的獨(dú)家推廣權(quán)�。目前,特瑞普利單抗在中國(guó)境內(nèi)外的臨床研發(fā)正在加速推進(jìn)�,至今已在中、美等多國(guó)開展了覆蓋超過(guò)15個(gè)適應(yīng)癥的30多項(xiàng)臨床研究��,并取得了一定成果���。祝賀君實(shí)生物的PD-1抗體特瑞普利單抗在中國(guó)獲批治療尿路上皮癌的新適應(yīng)癥��,希望該批準(zhǔn)能惠及更多患者���。
71
<menu id="yg8yk"><pre id="yg8yk"></pre></menu>
<menu id="yg8yk"></menu>
<abbr id="yg8yk"></abbr>
<table id="yg8yk"><pre id="yg8yk"></pre></table>





