中國國家藥品監(jiān)督管理局藥品審評中心(CDE)網(wǎng)站最新公示�����,信達(dá)生物三款抗腫瘤新藥獲得臨床試驗(yàn)?zāi)驹S可���,包括抗CTLA-4單克隆抗體IBI310����、抗GITR單克隆抗體IBI102和PD-1抑制劑信迪利單抗注射液�。根據(jù)CDE官網(wǎng),此次為IBI102首次在中國獲批臨床�����。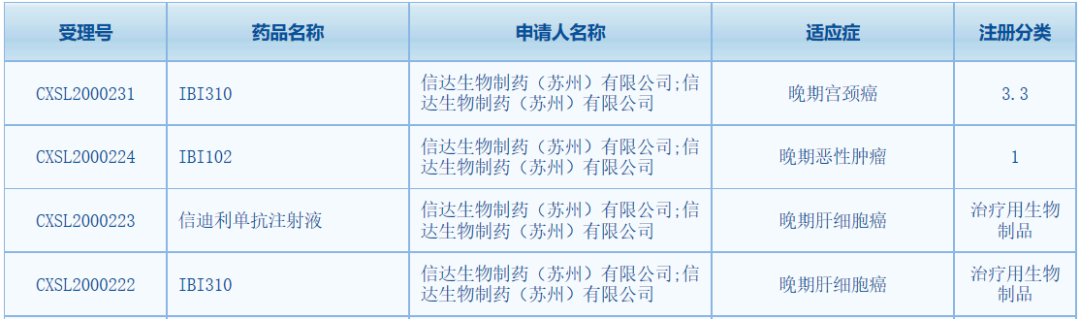
1��、藥品名稱:IBI310
作用機(jī)制/靶點(diǎn):抗CTLA-4單克隆抗體IBI310是一款由信達(dá)生物自主研發(fā)的重組全人源抗細(xì)胞毒性T淋巴細(xì)胞相關(guān)抗原-4(CTLA-4)單克隆抗體���。該產(chǎn)品通過靶向CTLA-4來上調(diào)人體效應(yīng)性T細(xì)胞介導(dǎo)的抗腫瘤免疫反應(yīng)和弱化調(diào)節(jié)性T細(xì)胞(Tregs細(xì)胞)介導(dǎo)的免疫抑制活性����,進(jìn)而抑制癌細(xì)胞的免疫逃逸��,提高機(jī)體免疫應(yīng)答�����。此次該產(chǎn)品在CDE獲得2項(xiàng)臨床試驗(yàn)?zāi)驹S可�����,適應(yīng)癥為晚期宮頸癌和晚期肝細(xì)胞癌���。根據(jù)藥物臨床試驗(yàn)登記與信息公示平臺�����,IBI310在中國登記開展了5項(xiàng)臨床試驗(yàn)�,適應(yīng)癥包括晚期肝細(xì)胞癌�����、黑色素瘤����、微衛(wèi)星不穩(wěn)定性高(MSI-H)或錯配修復(fù)缺陷(dMMR)晚期結(jié)直腸癌等。今年4月���,IBI310聯(lián)合信迪利單抗在中國用于輔助治療黑素瘤的3期注冊研究完成首例患者招募����。根據(jù)信達(dá)生物在今年ASCO年會上公布的一項(xiàng)早期研究�����,研究分為1a和1b期,其中1a期為IBI310單藥治療���,針對標(biāo)準(zhǔn)治療失敗的晚期實(shí)體腫瘤����;1b期為IBI310聯(lián)合信迪利單抗治療�����,針對晚期黑色素瘤�����。初步數(shù)據(jù)顯示��,IBI310聯(lián)合信迪利單抗前期的臨床研究結(jié)果展現(xiàn)出了一定的安全性和抗腫瘤活性��,顯示聯(lián)合療法可以發(fā)揮協(xié)同增強(qiáng)作用�����。2��、藥品名稱:IBI102
作用機(jī)制/靶點(diǎn):抗GITR單克隆抗體根據(jù)信達(dá)生物此前發(fā)布的新聞稿�,IBI102是一款抗GITR單克隆抗體,為1類生物新藥��。今年8月�,信達(dá)生物首次在中國提交IBI102的臨床試驗(yàn)申請并獲得受理。此次該產(chǎn)品獲得CDE臨床試驗(yàn)?zāi)驹S可���,擬開發(fā)用于晚期惡性腫瘤����。GITR是指糖皮質(zhì)激素誘導(dǎo)的腫瘤壞死因子受體(glucocorticoid-induced tumor necrosis factorreceptor����,GITR)蛋白,是TNFR超家族的新成員�。研究表明,GITR和其他共刺激分子一樣����,對T細(xì)胞的激活起著關(guān)鍵作用,它的活性可以通過協(xié)同作用增強(qiáng)其他抗癌療法的療效��,尤其是免疫檢查點(diǎn)抑制劑���。因此����,GITR已成為腫瘤免疫治療的一個潛在新靶點(diǎn)。根據(jù)早前在Science Immunology期刊中刊登的一篇論文�����,研究者在小鼠模型中的實(shí)驗(yàn)發(fā)現(xiàn)���,抗GITR抗體與抗PD-1抗體聯(lián)合使用能以協(xié)同的方式抵抗腫瘤生長���,同時,聯(lián)合療法還能促進(jìn)瘤內(nèi)CD8+T細(xì)胞的增殖���。3�、藥品名稱:信迪利單抗注射液
作用機(jī)制/靶點(diǎn):PD-1抑制劑信迪利單抗是信達(dá)生物和禮來公司(Eli Lilly and Company)共同開發(fā)的一款創(chuàng)新PD-1單克隆抗體��,已在2018年底在中國獲批用于治療復(fù)發(fā)/難治性經(jīng)典型霍奇金淋巴瘤����。去年11月,該藥被納入新版中國國家醫(yī)保目錄�����,成為首個進(jìn)入新版中國國家醫(yī)保目錄的PD-1抑制劑。在中國境外����,信迪利單抗還獲得了3個孤兒藥資格�����,分別針對外周T細(xì)胞淋巴瘤���、T細(xì)胞淋巴瘤和食管癌���。此次信迪利單抗注射獲得臨床試驗(yàn)?zāi)驹S可,擬開發(fā)適應(yīng)癥為晚期肝細(xì)胞癌��。CDE官網(wǎng)顯示�,該產(chǎn)品已在中國獲得多項(xiàng)臨床試驗(yàn)?zāi)驹S可,適應(yīng)癥涉及非鱗狀非小細(xì)胞肺癌(NSCLC)�、晚期/轉(zhuǎn)移性肝細(xì)胞癌、胃癌�、晚期惡性腫瘤等癌種。根據(jù)信達(dá)生物公開信息���,信迪利單抗目前有超過20多個臨床研究(其中10多項(xiàng)是注冊臨床試驗(yàn))正在進(jìn)行��,以評估其在各類實(shí)體腫瘤和血液腫瘤上的抗腫瘤作用�。值得一提的是,信迪利單抗用于非鱗狀NSCLC一線治療����、信迪利單抗與吉西他濱聯(lián)合用于治療一線鱗狀NSCLC患者的兩個新適應(yīng)癥申請也已分別獲得NMPA受理。此外�,該產(chǎn)品先后在單藥二線治療晚期/轉(zhuǎn)移性食管鱗癌的ORIENT-2研究,以及聯(lián)合用于晚期肝癌一線治療的3期ORIENT-32研究的期中分析中�����,達(dá)到主要研究終點(diǎn)���。祝賀信達(dá)生物三款新藥在中國獲批臨床�����,希望這些產(chǎn)品臨床開發(fā)進(jìn)展順利��,早日為中國癌癥患者帶來新的治療選擇���。



