寡核苷酸療法能夠直接調(diào)控基因表達(dá)�,它被認(rèn)為是繼小分子藥物和蛋白質(zhì)類藥物之后的新一類藥物開發(fā)熱點(diǎn)方向。根據(jù)近日發(fā)表在Nature Reviews Drug Discovery期刊上的一篇文章��,截止2020年1月��,全球范圍內(nèi)已經(jīng)有10款寡核苷酸藥物獲得美國(guó)FDA批準(zhǔn)上市����,同時(shí)還有至少20多款在研寡核苷酸藥物進(jìn)入臨床研究階段。本文中����,我們將結(jié)合發(fā)表在Nature上的這篇文章,以及公開資料����,帶大家了解下寡核苷酸療法的種類,以及當(dāng)下面臨的主要挑戰(zhàn)和應(yīng)對(duì)策略有哪些����。

圖片來源:123RF
寡核苷酸是一類包含20 個(gè)左右堿基的短鏈核苷酸的總稱��,包括DNA或RNA內(nèi)的核苷酸���。寡核苷酸可通過一系列過程來調(diào)節(jié)基因表達(dá),包括基因沉默��、剪接調(diào)節(jié)����、非編碼RNA抑制、基因激活���、基因編輯等等�����。因此,這類藥物具有治療多種疾病的潛力�����。大多數(shù)寡核苷酸通過堿基配對(duì)方式與同源目標(biāo)分子相互作用。此外��,核酸還可以通過形成三維二級(jí)結(jié)構(gòu)與蛋白質(zhì)相互作用�����,這一特性也被用于疾病治療藥物的開發(fā)�。例如,核酸適配體(aptamers)是一種結(jié)構(gòu)核酸配體�����,可作為特定蛋白的拮抗劑或激動(dòng)劑�����。同樣地��,含有發(fā)夾結(jié)構(gòu)的向?qū)NA分子也可以與外源引入的Cas9蛋白結(jié)合�,并將其引導(dǎo)到特定的基因組DNA位點(diǎn)進(jìn)行靶向基因編輯。寡核苷酸藥物理論上可以選擇性地靶向任何基因��,且具有最小的���,或至少可預(yù)測(cè)的脫靶效應(yīng)�����。此外��,它們也可以靶向罕見疾病患者的特異性基因序列��、特定的等位基因(例如單核苷酸多態(tài)性等)��、致病性融合轉(zhuǎn)錄本�、傳統(tǒng)的“不可成藥”靶點(diǎn),以及對(duì)某種寡核苷酸療法產(chǎn)生耐藥性的病毒序列等等����。這些優(yōu)勢(shì)和潛力使寡核苷酸成為了當(dāng)下的研究熱點(diǎn)。十款寡核苷酸藥物獲美國(guó)FDA批準(zhǔn)寡核苷酸作為藥物的研究大約始于三十年前�����。截至2020年1月�����,已有10款寡核苷酸藥物獲得美國(guó)FDA批準(zhǔn)上市��。寡核苷酸藥物的種類有很多,包括反義寡核苷酸(ASOs)���、小干擾核糖核酸(siRNA)、微小核糖核酸(miRNA)��、核酸適配體等等���。表 1 :FDA批準(zhǔn)上市的寡核苷酸藥物
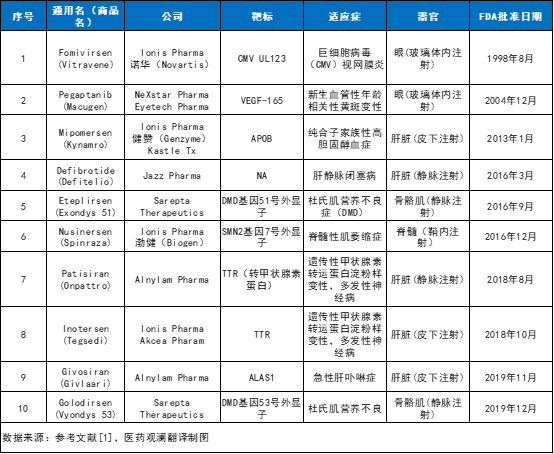
反義寡核苷酸是一種小的����、合成的具有不同化學(xué)性質(zhì)的單鏈核酸聚合物,可通過多種機(jī)制調(diào)控基因表達(dá)�。這類藥物可細(xì)分為兩大類: RNase H依賴(RNase H competent)型和空間位阻型(steric block)。內(nèi)源性RNase H酶Rnase H1識(shí)別RNA-DNA異質(zhì)雙鏈底物��,ASO結(jié)合位點(diǎn)的切割導(dǎo)致靶標(biāo)RNA的破壞����,從而沉默靶基因的表達(dá)。新一代的RNase H型ASOs通常遵循“gapmer”模式��,即一個(gè)基于DNA的中央“間隙”被基于RNA的側(cè)翼區(qū)域包圍,促進(jìn)目標(biāo)結(jié)合����。值得注意的是,Rnase H1在細(xì)胞質(zhì)和細(xì)胞核中都是活躍的�����,因此能夠靶向其他技術(shù)可能難以捕捉的核轉(zhuǎn)錄本�����。迄今為止����,已經(jīng)有3種 RNase H依賴型ASO藥物獲得批準(zhǔn)上市,分別為fomivirsen�����、mipomersen和inotersen(見表1)��。空間位阻寡核苷酸可與目標(biāo)轉(zhuǎn)錄本高親和力結(jié)合��,但由于缺乏募集RNase H能力��,它們不會(huì)誘導(dǎo)目標(biāo)轉(zhuǎn)錄本降解。這類寡核苷酸最廣泛的應(yīng)用是調(diào)節(jié)可變剪接���,以選擇性地排除或保留特定的外顯子���。然而��,同樣的技術(shù)也可以用于剪接破壞����,即跳過外顯子以中斷目標(biāo)基因的翻譯。此外�,空間位阻寡核苷酸也可能被用于促進(jìn)異型轉(zhuǎn)換,從而減少有害蛋白異型的表達(dá)和/或促進(jìn)有益蛋白異型的表達(dá)��。截至2020年1月��,已經(jīng)有3種剪接轉(zhuǎn)換ASO藥物獲得FDA批準(zhǔn)�����,分別為eteplirsen����、golodirsen和nusinersen(見表1)���。siRNA是一類雙鏈RNA分子:它的一條鏈成為引導(dǎo)鏈(又稱反義鏈)��,與靶標(biāo)轉(zhuǎn)錄物互補(bǔ)��;另一條鏈為正義鏈�����。作為RNA誘導(dǎo)沉默復(fù)合物(RISC)的一部分���,siRNAs引導(dǎo)Argonaute 2蛋白(AGO2)與目標(biāo)轉(zhuǎn)錄本互補(bǔ)����,在AGO2的催化下����,引導(dǎo)鏈的相反位置被切割,進(jìn)而導(dǎo)致基因沉默����。目前至少兩種siRNAs藥物已獲得FDA批準(zhǔn),分別為patisiran和givosiran�����。miRNA是一類由內(nèi)源基因編碼的非編碼單鏈RNA分子�����,由具有發(fā)夾結(jié)構(gòu)的單鏈RNA前體經(jīng)過Dicer酶加工后生成��。miRNA與多種生理和病理過程有關(guān)�����,包括癌癥�、細(xì)胞周期進(jìn)展��、傳染病���、免疫��、糖尿病����、新陳代謝��、肌生成和肌肉營(yíng)養(yǎng)不良,因此成為了新藥開發(fā)的一個(gè)重要靶點(diǎn)��。與siRNA一樣����,miRNA可以將RNA誘導(dǎo)的沉默復(fù)合物(RISC)引導(dǎo)至靶序列,從而啟動(dòng)基因沉默����。目前,已有許多公司在開發(fā)miRNA藥物��。例如�,Regulus公司正在開發(fā)靶向miR-21和miR-17的miRNA寡核苷酸藥物,擬分別治療Alport腎?�。ˋlport nephropathy)���、多囊腎(polycystic kidney disease)�����。miRagen公司正在開發(fā)多種miRNA候選藥物:其中cobomarsen是一種靶向miR-155的寡核苷酸抑制劑���,擬開發(fā)治療皮膚T細(xì)胞淋巴瘤��;remlarsen是一種靶向miR-29的雙鏈模擬物���,擬開發(fā)治療瘢痕疙瘩(keloids)。許多基因表達(dá)長(zhǎng)的非編碼RNA,它們通常與近端蛋白質(zhì)編碼基因的轉(zhuǎn)錄抑制有關(guān)�����。用稱為小激活RNA的寡核苷酸片段靶向這些長(zhǎng)的非編碼RNA可以逆轉(zhuǎn)這種負(fù)調(diào)控的作用��,從而導(dǎo)致轉(zhuǎn)錄激活����,這已在許多疾病相關(guān)的基因中得到顯示�����,包括BACE1(阿爾茨海默?。?em style="margin: 0px; padding: 0px; max-width: 100%; box-sizing: border-box !important; word-wrap: break-word !important;">BDNF(帕金森病)�����、UBE3A(安格曼綜合征)和SCN1A(Dravet綜合征)等等����。目前,內(nèi)源性小激活RNA在細(xì)胞核內(nèi)的重要性已經(jīng)越來越受到重視����,作為轉(zhuǎn)錄基因激活或沉默的天然介質(zhì),內(nèi)源性小激活RNA可能本身就構(gòu)成了寡核苷酸療法的靶點(diǎn)����。目前,已有許多公司在開發(fā)小激活RNA��。例如���,MiNA Therapeutics正在開發(fā)MTL-CEBPA�����,這是一種靶向CEBPA(一種參與肝細(xì)胞分化和腫瘤抑制的關(guān)鍵轉(zhuǎn)錄因子)的小激活RNA��,以脂質(zhì)納米顆粒制劑的形式遞送�����,用于治療肝細(xì)胞癌��。目前�����,該在研藥正在肝細(xì)胞癌和肝硬化患者中開展1期臨床試驗(yàn)����。激活特定基因的另一種方法是Stoke Therapeutics的TANGO技術(shù)平臺(tái),該技術(shù)靶向非生產(chǎn)性RNA剪接以增加基因表達(dá)�,并解決由于基因功能喪失或降低而導(dǎo)致的單基因疾病。該公司目前的主要候選藥為STK-001�����。STK-001是一種反義寡核苷酸藥物���,擬開發(fā)治療Dravet綜合征。臨床前研究數(shù)據(jù)顯示��,在Dravet綜合征小鼠模型中,STK-001提高了小鼠的生存率��,并降低了癲癇發(fā)作頻率��。目前�,該在研藥正在開展1/2a期臨床試驗(yàn)。

圖片來源:123RF
雖然全球已經(jīng)有十余款寡核苷酸療法獲批上市����,但寡核苷酸療法的廣泛應(yīng)用仍面臨一個(gè)主要挑戰(zhàn)——如何將寡核苷酸藥物有效輸送到肝臟以外的目標(biāo)器官和組織。迄今為止�����,大多數(shù)寡核苷酸療法���,包括幾乎所有已批準(zhǔn)的核酸藥物�����,都是局部給藥����,例如眼睛�����、脊髓、肝臟���。寡核苷酸通常是大的親水性多聚陰離子�����,這種特性意味著它們不容易通過質(zhì)膜�����。由于基于寡核苷酸的治療藥物通常無法穿越血腦屏障(BBB)���,因此向中樞神經(jīng)系統(tǒng)(CNS)的遞送是一個(gè)額外的挑戰(zhàn)。目前��,科學(xué)家們正在開發(fā)許多方法和技術(shù)���,來解決寡核苷酸藥物遞送這一大難題���。化學(xué)修飾是增強(qiáng)寡核苷酸藥物遞送的最有效方法之一����,這種方法利用修飾來改善寡核苷酸的藥代動(dòng)力學(xué)��、藥效學(xué)和生物分布����,以提高藥物的遞送能力�����。生物偶聯(lián)也是解決寡核苷酸藥物遞送的有效途徑��。ASOs和siRNA的遞送潛力可以通過直接共價(jià)偶聯(lián)不同的“元件”來增強(qiáng)�����,這些“元件”包括脂質(zhì)���、肽�、適配體�����、抗體和糖分子�,通過偶聯(lián)可使寡核苷酸更容易接近目標(biāo)細(xì)胞����。納米技術(shù)和材料科學(xué)的發(fā)展也為解決寡核苷酸藥物遞送的挑戰(zhàn)提供了優(yōu)勢(shì)和潛在的解決方案���,尤其是針對(duì)跨越生物屏障和跨膜細(xì)胞內(nèi)遞送的要求����。此外�����,研究人員也在開發(fā)一些新的技術(shù)��,如內(nèi)源性囊泡(即外泌體)��、球型核酸(SNAs)����、納米技術(shù)(例如DNA籠)和“智能”材料等等。寡核苷酸療法的到來�����,讓很多疾病的治療成為了可能。許多藥物的獲批表明寡核苷酸藥物的遞送現(xiàn)已成熟���,可臨床用于多種適應(yīng)癥。根據(jù)文章����,全球范圍內(nèi),目前還有至少20多種在研寡核苷酸療法已在臨床開發(fā)階段����,適應(yīng)癥涉及亨廷頓病、阿爾茨海默病�����、肌萎縮側(cè)索硬化(ALS)����、血友病、肝細(xì)胞癌等等����。我們期待,在科學(xué)家�、醫(yī)藥企業(yè)、患者組織等社會(huì)各界的齊心協(xié)力下,寡核苷酸療法的研究可以取得更多的研究和突破�,造福更多患者。





