中國國家藥監(jiān)局藥品審評中心(CDE)網(wǎng)站最新公示顯示��,阿諾醫(yī)藥在中國提交了PI3K抑制劑buparlisib (AN2025)的臨床試驗申請�。Buparlisib最初由諾華公司(Novartis)開發(fā),阿諾醫(yī)藥現(xiàn)在擁有該藥的全球獨家權(quán)益�����。目前��,buparlisib尚未在全球任何國家和地區(qū)上市����。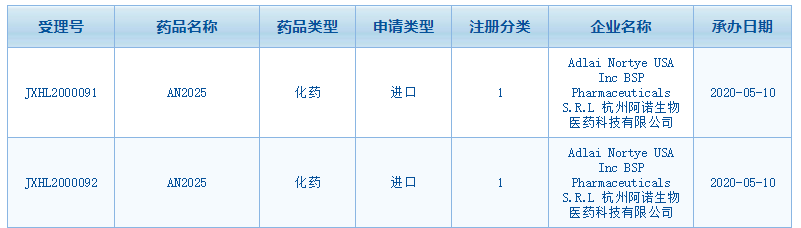
Buparlisib是一種具有腫瘤免疫(I/O)作用的口服泛PI3K抑制劑��,可針對所有的I類PI3K亞型�,在血液惡性腫瘤和實體瘤中都很活躍。2018年7月�����,阿諾醫(yī)藥與諾華公司簽署一項全球許可協(xié)議,通過支付首付款�����、里程碑金和銷售提成的方式���,獲得腫瘤治療藥物buparlisib 的全球獨家開發(fā)�����、生產(chǎn)與銷售權(quán)利�。根據(jù)阿諾醫(yī)藥早前發(fā)布的新聞稿��,諾華此前已完成了buparlisib在與紫杉醇聯(lián)合治療頭頸部鱗狀細胞癌的全球臨床2期臨床試驗�,并取得了良好的療效,患者的中位生存時間達到了10.4個月��?��;诖?����,美國FDA已授予該藥快速審批通道資格��。此外�����,動物試驗數(shù)據(jù)顯示��,AN2025也有治療PD-1藥物無應(yīng)答或者PD-1耐受的腫瘤的潛力��。根據(jù)阿諾醫(yī)藥在2019年3月發(fā)布的動物試驗數(shù)據(jù)���,AN2025顯著抑制了腫瘤的生長��,并且在PD-1無應(yīng)答的小鼠腫瘤治療中表現(xiàn)出劑量反應(yīng)的趨勢�����。目前,buparlisib已獲得美國FDA批準(zhǔn)開展3期臨床試驗�����,該研究將評估AN2025聯(lián)合紫杉醇治療與紫杉醇單獨治療頑固性�、復(fù)發(fā)性或轉(zhuǎn)移性頭頸癌的效果,參與3期臨床試驗的患者將包含經(jīng)鉑類化療或PD-1治療失敗的病人。

在中國���,本次是阿諾醫(yī)藥首次提交buparlisib 的臨床試驗申請�。但是��,中國藥物臨床試驗登記與信息公示平臺�����,諾華早前已在晚期實體腫瘤���、局部晚期或轉(zhuǎn)移性乳腺癌中開展了兩項關(guān)于buparlisib的研究��。



