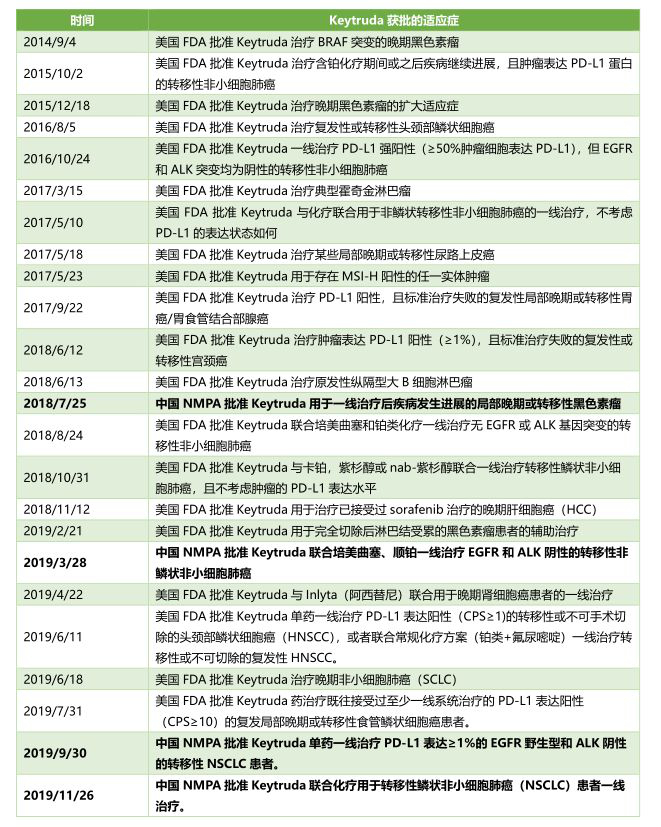
近日����,BioSpace回顧了2019年10大新聞事件,本文對此進行編譯�,以饗讀者�。在過去的幾年里����,隨著多家公司接連宣告阿爾茲海默癥藥物的研發(fā)失敗���,Biogen的aducanumab成為了最后的希望。然而����,2019年3月,Biogen及其合作伙伴日本生物制藥公司Eisai(衛(wèi)材)宣布:將停止針對aducanumab治療阿爾茨海默氏癥輕度認知障礙患者的兩項全球III期臨床試驗ENGAGE和EMERGE����,以及EVOLVEII期試驗和PRIME Ib期長期試驗。其原因在于獨立數(shù)據(jù)監(jiān)測委員在對這些試驗進行無效性分析(futility analysis)后表示����,很難達到其主要終點。10月22日����,這兩家公司卻再次宣布,EMERGE III期試驗中aducanumab高劑量組達到其主要終點���,且高劑量組部分患者在接受藥物治療后����,在包括記憶力、方向感和語言等在內(nèi)的認知和功能指標上有了明顯改善�,并在生活活動方面也表現(xiàn)明顯益處。該公司在與美國FDA進行進一步地討論后表示���,計劃將在2020年初提交生物制品許可上市申請��,并將繼續(xù)與包括歐洲和日本在內(nèi)的國際市場監(jiān)管機構進行協(xié)商�����。12月5日����,Biogen公司在美國圣地亞哥舉行的第12屆阿爾茲海默癥臨床試驗(CTAD)會議上,公開了aducanumab試驗的全部數(shù)據(jù)���。學界和投資界并沒有被這一消息沖昏頭腦��,大多數(shù)人仍保持審慎態(tài)度�。他們認為盡管出現(xiàn)了一些讓人令人激動的積極數(shù)據(jù)����,但兩項試驗中仍存在令人擔憂的安全信號和混合結果���,可能影響FDA是否批準其上市申請���。aducanumab為治療阿爾茲海默癥提供了新的希望����,但這一新藥的“過山車式經(jīng)歷”仍在繼續(xù)……今年6月����,默沙東首席商務官Frank Clyburn在5年來首個投資者日會議上表示���,在不久的未來����,Keytruda(帕博利珠單抗)將成為一種基礎性的癌癥治療方法��。“目前我們的臨床試驗涉及到了25種不同類型的癌癥……而Keytruda正在改變當今患者的治療方式���。”盡管彼時許多分析師對該公司過度依賴該產(chǎn)品而感到擔憂�����,但隨著Keytruda適應癥的不斷獲批,Clyburn的這些預言被證明不是為了哄抬股價而夸下的?���?凇?/span>有分析家認為��,Keytruda即將取代Humira(2023年失去美國市場專利保護)在2025年之后成為世界上銷量最大的藥物�。并且,Keytruda 自2014年以來已經(jīng)獲得了20多項適應癥批準�����,隨著2020年的到來,Keytruda也可能會獲得更多的批準�,有望在未來獲得更多收入。
并購是日新月異的生物技術行業(yè)不變的主題�。2019年�,隨著一些并購案的發(fā)生,行業(yè)格局也發(fā)生了幾次大規(guī)模的變化���。
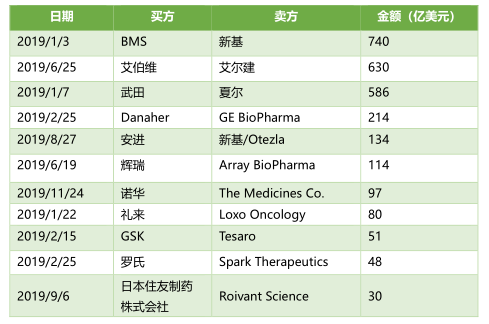
首先不得不提及的是�����,1月�,BMS宣布將以740億美元收購Celgene。這兩家制藥巨頭的“強強聯(lián)手”創(chuàng)造了腫瘤學����、血液學、免疫學和心血管疾病領域的巨擘�����。自合并以來�����,BMS先后獲批了一些藥物上市���,其中包括由Celgene開發(fā)�����,已被FDA批準用于治療患有β地中海貧血癥的成年患者的Reblozyl(luspatercept-AAMT)��。6月�����,AbbVie宣布斥資630億美元收購肉毒桿菌生產(chǎn)商艾爾建(Allergan)�����。達成最終交易協(xié)議時��,艾伯維方面表示�����,艾爾建現(xiàn)有管線和產(chǎn)品的增加將立即為公司的產(chǎn)品布局帶來更大的效益規(guī)模�,以減少目前對重磅藥物Humira的過度依賴��。自合并后,該公司將在免疫學��、血液腫瘤學����、醫(yī)學美學、神經(jīng)科學���、婦女健康��、眼睛護理和病毒學方面擁有一些產(chǎn)品的特許經(jīng)營權��。盡管以上兩個事件是2019年最大手筆的并購案����,但還有一些并購案�����,也在影響著整個生物技術領域的風云變化����。例如:Mylan與輝瑞普強(Upjohn)的合并。這一新公司將通過整合原兩家公司高度互補的業(yè)務�����,進一步拓展市場���。全新的產(chǎn)品管線中將出現(xiàn)許多知名品牌�,如預計Epi-Pen��,Viagra�����,Lipitor����,Celebrex等,預計將在2020年收入達到200億美元����。2019年1月, BMS豪擲740億美元收購Celgene成為本年度最大手筆的交易��。9月���,日本住友制藥株式會社(Sumitomo Dainippon Pharma)與Roivant Science公司所達成的一項高達30億美元的交易也頗受圈內(nèi)人的關注�。日本住友制藥以30億美元的預付款買下Roivant Sciences公司旗下5家“Vant系”子公司,同時��,住友制藥還將獲得Roivant公司10% 的股份���,以及收購另外6家企業(yè)的選擇權��。根據(jù)交易細節(jié)披露�����,日本住友制藥將新建一家公司�����,將已收購的Myovant Sciences (女性健康和前列腺癌)��、Urovant Sciences (泌尿系統(tǒng)疾病)��、Enzyvant Therapeutics (兒童罕見疾病)�����、Altavant Sciences (呼吸系統(tǒng)罕見疾病) �����,以及Spirovant Sciences(囊性纖維化的基因療法)這5家公司納入到統(tǒng)一管理中�����。同時�����,這家新公司將由前基因泰克高管�、Roivant的執(zhí)行主席Myrtle Potter暫為管理運營�。此外,除了30億美元的預付款�����,日本住友制藥還將需要為Myovant Sciences公司提供3.5億的貸款�����,用于治療子宮肌瘤臨床III候選藥物relugolix的后續(xù)研究及上市申請���;以及為Urovant Sciences公司提供2億美元的貸款�����,用于膀胱過度活動癥藥物vibegron的后續(xù)開發(fā)�����。未來�,如果日本住友制藥行使繼續(xù)收購其他6家公司的選擇權,還有望在2020年到2022年間獲得超過25種在研藥物的開發(fā)工作�,以及Roivant專有技術平臺DrugOme和Digital Innovation的使用權。2018年11月����,南方科技大學原副教授賀建奎聲稱,其利用CRISPR-Cas9基因編輯技術改變了7對夫婦的胚胎DNA����,并創(chuàng)造出全球首例免疫艾滋病基因編輯雙胞胎,引發(fā)基因編輯倫理丑聞��。對此�,2019年3月13日,包括張峰��、Emmanuelle Charpentier在內(nèi)的7個國家的18位領先研究人員和生物倫理學家在《Nature》雜志上發(fā)表文章《Adopt a moratorium on heritable genome editing》��,呼吁在全球范圍內(nèi)暫停人類生殖系基因編輯的所有臨床用途。同時他們還表示:“‘全球暫?!⒉灰馕吨谰媒埂?/span>相反�����,我們呼吁建立一個國際框架�,在這個框架中,各國在保留自己決定權的同時����,自愿承諾除非滿足某些條件���,否則不予批準任何臨床生殖系的基因編輯試驗�。”2019年12月30日�,據(jù)新華社報道,“基因編輯嬰兒”案在深圳市南山區(qū)人民法院一審公開宣判��。賀建奎�、張仁禮、覃金洲等3名被告人因共同非法實施以生殖為目的的人類胚胎基因編輯和生殖醫(yī)療活動���,構成非法行醫(yī)罪���,分別被依法追究刑事責任����。2019年11月11日���,歐盟委員會(EC)批準默沙東(Merck & Co)的埃博拉疫苗Ervebo(V920)上市��,成為全球首款獲批上市的埃博拉疫苗���。12月19日, FDA同樣宣布批準Ervebo上市�,成為了FDA批準的首款用于18歲及以上人群的主動免疫,以預防扎伊爾型埃博拉病毒(Ebola Zaire)引起的埃博拉病毒?。‥VD)。2018年8月以來���,剛果民主共和國爆發(fā)了該地區(qū)有史以來第二大的埃博拉疫情��,在此期間約有2000多人死于該疾病�����。在該疫苗獲批之前�����,默沙東便為該地區(qū)提供了該疫苗的大量研究制劑����,并完成了超25萬人次的疫苗接種。此外��,強生旗下的楊森制藥公司也正在開發(fā)另外一種埃博拉疫苗�����,該疫苗目前已給予剛果東部戈馬市中的5萬人使用�。與默克1針疫苗方案相比,強生疫苗需要在首針注射8周后�����,進行再次注射����。該疫苗目前已向歐洲藥品管理局(EMA)提交了2份營銷授權申請(MAA)�����。曾經(jīng)以阿片類止痛藥OxyContin(奧施康定)聞名的普渡制藥(Purdue Pharma),因深陷數(shù)千起與阿片類藥物成癮危機有關的訴訟����,并無力支付100-120億美元的法律和解費用,從而申請破產(chǎn)���。當?shù)卣_指責了該公司因過度積極推銷處方止痛藥OxyContin���,并在該產(chǎn)品的過量風險提示上誤導醫(yī)生和患者,進而助長了美國阿片類藥物危機����。截止目前美國社會已有數(shù)千人因阿片類藥物過量服用而死亡。在普渡制藥申請破產(chǎn)的同時�����,其資產(chǎn)將被重組為一家新的公司�����,且新公司的董事會將由債權人選出�,由破產(chǎn)法院批準。根據(jù)聲明���,這家新公司將以幾乎0成本的方式來生產(chǎn)治療阿片成癮的相關藥物��,例如納美芬和納洛酮����。因出現(xiàn)問題而召回藥物的情況在歷史上并不少見。而2019年的較多藥物召回事件似乎都與制藥工藝過程中存在致癌物質(zhì)有關����。自2018年華海藥業(yè)的纈沙坦事件后,F(xiàn)DA一直在針對高血壓和心衰藥品(稱為ARB)中的NDMA(N-亞硝基二甲胺)和其他亞硝酸胺類雜質(zhì)進行調(diào)查���,并建議召回了許多制造商的多種類型的血管緊張素II受體阻滯劑產(chǎn)品���。 直到2019年9月13日,F(xiàn)DA�、EMA發(fā)文表示:不僅僅是降壓藥物受到污染,相關雷尼替丁藥品(一種抑制胃酸分泌的藥物���,可用于治療消化性潰瘍等疾病的經(jīng)典治療藥物。)中也含有低水平亞硝胺雜質(zhì)NDMA�����。于是,雷尼替丁的召回風波開啟了��。在美國FDA發(fā)出安全警告后�����,陸續(xù)有多家跨國藥企自愿召回產(chǎn)品并遭受沖擊��。先是諾華宣布暫停山德士公司在市場銷售所有含有雷尼替丁的藥物��,包括在美銷售的膠囊藥物���,涉及26個國家�。GSK也宣布��,暫停向包括印度在內(nèi)的全球市場供應雷尼替丁藥物�����,并啟動召回��,以作為預防措施�����,以待全球正在進行的測試和調(diào)查得出結果。其他藥企諸如印度瑞迪博士藥廠���、山德士公司���、加拿大Apotex制藥公司、印度Strides制藥陸續(xù)表示���,暫停其雷尼替丁藥物在全球或美國的供應或銷售����、自愿召回美國境內(nèi)相關批次�����、某些規(guī)格����、相關供應原料生產(chǎn)的雷尼替丁。2018年11月����,雅培實驗室的研究人員發(fā)現(xiàn)了一種新的HIV毒株��,這也是近20年來首次發(fā)現(xiàn)的一種新的HIV-1亞型,它的起源可以追溯至非洲的剛果民主共和國���。這一新菌株的發(fā)現(xiàn)���,意味著研究人員或可開發(fā)出針對艾滋病的潛在新療法。自艾滋病在全球流行以來���,已有超過7500萬人曾被HIV病毒感染��。這一曾經(jīng)近似“死刑”宣判的疾病�����,隨著新藥物和新療法的發(fā)展����,已有超3790萬人得以控制病情并繼續(xù)存活下來�。除此之外,今年還有很多針對HIV病毒的新療法獲批���。例如�,默沙東Pifeltro和Delstrigo被批準聯(lián)合用藥治療HIV-1患者;吉利德公司的Descovy被批準用于HIV暴露前預防�。此外,還有許多新的療法尚在研發(fā)之中�,例如,GSK旗下ViiV的Cabotegravir和楊森的rilpivirine聯(lián)合用藥����;北京大學鄧宏魁教授及其團隊發(fā)明的使用CRISPR技術和調(diào)節(jié)蛋白BRD4的骨髓移植;長非編碼RNA的遺傳修飾等等�。隨著2019年這些潛在療法的發(fā)現(xiàn),將為未來HIV患者的治療帶來更多的選擇��。近年來�,3D打印技術逐漸成熟。2019年4月��,特拉維夫大學的研究人員使用患者自己的細胞及各種生物材料成功地打印了第一顆含有血管的3D仿生心臟�。領導該研究的Tal Dvir教授表示:“這顆心臟是由患者的細胞和特定的生物材料制成的。在我們的工藝過程中��,這些材料可作為生物墨水(由糖和蛋白質(zhì)制成的物質(zhì))�,用于復雜組織模型的3D打印。過去人們設法對心臟結構進行3D打印���,然而無法打印出相應的細胞或血管�����。我們的研究結果證明了未來設計出可替代的個性化組織和器官的潛力����。”這也將意味著��,人類已在3D打印器官方面取得重大突破�����,其發(fā)展方向不僅是為了科學研究��,也可能是為了器官替代���。



