繼今年10月與羅氏達成合作后,應(yīng)世生物創(chuàng)新抗癌藥IN10018片又迎來新進展。中國國家藥監(jiān)局藥品審評中心(CDE)網(wǎng)站最新數(shù)據(jù)顯示����,IN10018片已在中國獲得臨床試驗?zāi)驹S可��,適應(yīng)癥為局部晚期或轉(zhuǎn)移性胃或胃食管交界處腺癌��,這是應(yīng)世生物成立以來在中國獲得的首個臨床批件�����。IN10018片是應(yīng)世生物從勃林格殷格翰(BI)引進的一款黏著斑激酶(FAK)抑制劑����,今年8月該藥剛在美國獲得臨床試驗許可(IND)����。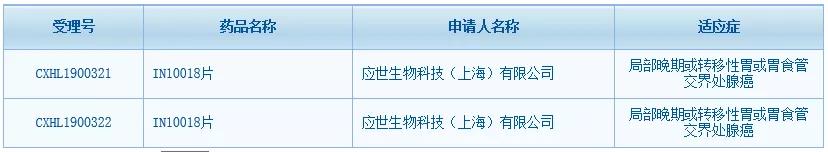
IN10018是勃林格殷格翰開發(fā)的一款FAK抑制劑,應(yīng)世生物現(xiàn)在擁有該藥的全球開發(fā)和商業(yè)化權(quán)利�。FAK在許多對腫瘤發(fā)展至關(guān)重要的細胞功能如粘附、遷移��、增殖和免疫逃逸中都起作用,F(xiàn)AK抑制劑可通過癌細胞或免疫介導(dǎo)作用來抑制腫瘤生長和轉(zhuǎn)移���。臨床前研究表明�,IN10018能顯著提高化療�����、放療����、靶向藥物、以及免疫治療的療效�����,形成協(xié)同效應(yīng)�,克服耐藥,有望成為諸多治療藥物的最佳聯(lián)合治療藥物�����。2019年8月30日��,IN10018在美國獲得臨床試驗許可(IND)��,這是應(yīng)世生物首個獲得FDA臨床試驗許可的創(chuàng)新藥。10月12日�,應(yīng)世生物宣布與羅氏制藥達成一項全球范圍內(nèi)的臨床試驗合作,對IN10018與羅氏旗下的小分子MEK抑制劑cobimetinib展開聯(lián)合用藥臨床研究���,以評估聯(lián)合療法在葡萄膜黑色素瘤癌癥患者中的安全性��、耐受性��、以及抗腫瘤療效��。根據(jù)應(yīng)世生物官網(wǎng)公開信息��,IN10018是應(yīng)世生物產(chǎn)品管線中進展最快的藥物�。該藥正在與靶向藥物�、化療、免疫療法��、放療開展聯(lián)合研究����,在黑色素瘤�、卵巢癌、胃癌��、胰腺癌和非小細胞肺癌中的研究已進入1期臨床階段。

應(yīng)世生物由王在琪博士于2018年12月創(chuàng)立��,王在琪博士曾在羅氏����、默沙東、禮來等公司任職��,擁有20年豐富的臨床開發(fā)經(jīng)驗���,并負責(zé)過Keytruda與Gardasil的中國臨床試驗與注冊上市���。

應(yīng)世生物董事長兼首席執(zhí)行官王在琪博士(圖片來源:應(yīng)世生物官網(wǎng))
以疾病生物學(xué)為創(chuàng)新源頭,應(yīng)世生物致力于打造“最佳聯(lián)合用藥研發(fā)策略”���,建立具備快速臨床轉(zhuǎn)化與概念驗證能力的平臺���,成為一家在新藥研發(fā)2.0時代立足于中國服務(wù)全球新藥研發(fā)公司。目前該公司已經(jīng)完成數(shù)千萬美元的A輪融資�����。除了IN10018外���,該公司的產(chǎn)品線還包括一款針對肝癌和結(jié)直腸癌的候選藥物IN10126�����,目前正處于IND準備階段�,以及一款正處于探索階段的候選藥物IN30101。我們祝賀應(yīng)世生物FAK抑制劑IN10018片在中國獲得臨床試驗?zāi)驹S可�,希望該藥的臨床試驗并順利開展并取得好的結(jié)果,為患者帶來更多的治療選擇�。





