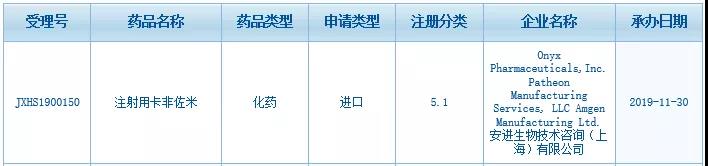
根據(jù)中國(guó)國(guó)家藥監(jiān)局藥品審評(píng)中心(CDE)最新公示�����,安進(jìn)公司(Amgen)旗下的注射用卡非佐米(carfilzomib)在中國(guó)的上市申請(qǐng)已獲得CDE受理�����。這是一款蛋白酶體抑制劑�����,用于治療多發(fā)性骨髓瘤。值得一提的是�����,今年11月初�����,百濟(jì)神州與安進(jìn)達(dá)成全球腫瘤戰(zhàn)略合作關(guān)系�����,將在中國(guó)開發(fā)和商業(yè)化多款安進(jìn)已獲批的腫瘤產(chǎn)品�����,還將在全球范圍內(nèi)共同開發(fā)20款抗腫瘤藥物�����。其中在中國(guó)商業(yè)化合作部分就包括這款藥物——KYPROLIS?(carfilzomib)�����,它正在中國(guó)開發(fā)后期用于治療多發(fā)性骨髓瘤。
細(xì)胞內(nèi)的蛋白酶體(proteasomes)能夠分解受損或不再需要的蛋白�����,它對(duì)細(xì)胞的正常功能和生長(zhǎng)都有重要的作用�����。Carfilzomib是安進(jìn)公司開發(fā)的第二代蛋白酶體抑制劑�����,它的作用機(jī)制在于�����,通過(guò)阻斷蛋白酶體分解蛋白的功能�����,導(dǎo)致細(xì)胞內(nèi)蛋白的過(guò)度積累�����。在有些細(xì)胞中�����,carfilzomib會(huì)導(dǎo)致細(xì)胞死亡�����。由于骨髓瘤細(xì)胞中含有大量異常蛋白�����,因此�����,carfilzomib引發(fā)骨髓瘤細(xì)胞死亡的效果尤其明顯�����。

2016年�����,carfilzomib獲得美國(guó)FDA批準(zhǔn)�����,可以作為單一療法或者與dexamethasone或dexamethasone + lenalidomide構(gòu)成組合療法治療復(fù)發(fā)或難治性MM患者。它同時(shí)也在澳大利亞�����、加拿大�����、中國(guó)香港�����、日本�����、韓國(guó)�����、瑞士�����、俄羅斯等國(guó)家和地區(qū)獲得批準(zhǔn)上市�����。自獲批以來(lái)�����,全球有接近8萬(wàn)名患者已經(jīng)接受過(guò)carfilzomib的治療�����。
在一項(xiàng)名為ASPIRE的臨床3期試驗(yàn)中�����,792名復(fù)發(fā)或難治性MM患者接受了KRd或Rd的治療�����。這些患者已經(jīng)接受過(guò)1~3種其它療法的治療�����。試驗(yàn)結(jié)果表明�����,接受KRd療法患者組的平均OS為48.3個(gè)月,接受Rd療法患者組的平均OS為40.4個(gè)月�����。KRd療法能夠?qū)S延長(zhǎng)7.9個(gè)月�����。在只接受過(guò)一次其它療法治療的患者亞群中�����,KRd療法的療效更好�����,與Rd療法相比能夠?qū)⑵骄鵒S延長(zhǎng)11.4個(gè)月�����。患者的無(wú)進(jìn)展生存期(PFS)數(shù)據(jù)已經(jīng)在去年發(fā)表�����,KRd與Rd療法相比�����,能夠?qū)FS延長(zhǎng)8.7個(gè)月�����。多發(fā)性骨髓瘤(multiple myeloma, MM)是一種血液系統(tǒng)惡性腫瘤�����,無(wú)法治愈且復(fù)發(fā)率很高�����。它是由于骨髓中的漿細(xì)胞癌變導(dǎo)致的罕見但是危及生命的血癌�����,占癌癥總數(shù)的2%左右�����。它的一個(gè)重要特征是會(huì)反復(fù)出現(xiàn)緩解和復(fù)發(fā)�����。我們期待這款藥物早日獲批上市,造福更多多發(fā)性骨髓瘤患者�����。



